
某同学按图示装置进行实验:A极是铜锌合金,B极为纯铜,溶液为足量的硫酸铜溶液。通电一段时间后,若A极恰好全部溶解,此时B极质量增加5.76g,溶液质量增0.03g,则合金中Cu、Zn原子个数比为
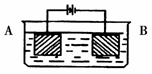
A.4:1 B.3:1 C.2:1 D.任意比
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
下列关于溶液和胶体的叙述中不正确的是 ( )
A.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
B.在胶体中加入少量电解质溶液时,可能使胶体发生聚沉
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗 运动
运动
D.溶液中溶质粒子小于1nm,而胶体粒子直径在1nm~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能成功的是( )
A、用1体积的乙醇与3体积的浓H2SO4混合加热到140℃制乙烯
B、加入适量浓溴水除去苯中混有的少量苯酚
C、用饱和食盐水和电石(CaC2)在启普发生器中制乙炔
D、以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:
盐酸>碳酸>石炭酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,几种酸的电离常数如下:Ka(HCN)= 6.2×10-10 mol·L-1、Ka(HF)= 6.8×10-4 mol·L-1、Ka(CH3COOH)= 1.8×10-5 mol·L-1、、Ka(HNO2)= 6.4×10-6mol·L-1。则物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.NaCN B.NaF C.CH3COONa D.NaNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
MOH和ROH两种一元碱的溶液分别加水稀释时,
pH变化。如右图所示。下列叙述中正确的是
A.ROH是一种弱碱
B.在x点,c(M+) = c(R+)
C.在x点, MOH完全电离
D.稀释前,c(ROH) =10 c(MOH)
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
。
(2)在压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的△H 0
 (填“<”、“>”或“=”)。
(填“<”、“>”或“=”)。
②在温度容积不变的情况下,向该密闭容器再
增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
 (3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
(3)实验室中配制AgNO3溶液时通常需要向其中加入 ,目的是 ; AgCl在水中存在沉淀溶解平衡:
AgCl(s)  Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l00mL 0.2 mol•L-1AgNO3溶液;③100mL 0.1 mol•L-1氯化镁溶液;④100mL 0.1 mol•L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.H2S的稳定性比HF的稳定性强
B.某元素X的气态氢化物的化学式为H2X,则其最高价氧化物的化学式为XO3
C.离子化合物中可能含有共价键,共价化合物中可能含有离子键
D.一个D2O分子所含的中子数为8
查看答案和解析>>
科目:高中化学 来源: 题型:
可以将反应Zn+Br2===ZnBr2设计成蓄电池,下列4个电极反应:
①Br2+2eˉ= 2Brˉ ②2Brˉ﹣2eˉ = Br2
③Zn ﹣2eˉ= Zn2+ ④Zn2++2eˉ = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是 ( )
A.②和③ B.②和① C.③和① D.④和①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com