
| A. | Cu$\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{硝酸银溶液}{→}$Cu(NO3)2 | D. | Cu $\stackrel{氧气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
分析 绿色化学的理念是原料的利用率高,对环境无污染,因此从这二个方面分析制备等质量硝酸铜需要的原料及对环境是否存在污染来考虑,据此可选择最合理的选项;
A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应生成有毒气体;
B.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,反应生成有毒气体;
C.Cu+2AgNO3═Cu(NO3)2+2Ag,硝酸银比较昂贵,原料成本高;
D.2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO,CuO+2HNO3=Cu(NO3)2+H2O,消耗的硝酸较少且产物没有污染.
解答 解:A.生成1mol硝酸铜,消耗4mol硝酸,同时产生二氧化氮有毒气体,故A不选;
B.生成1mol硝酸铜,消耗$\frac{8}{3}$mol硝酸,同时产生一氧化氮有毒气体,故B不选;
C.反应消耗硝酸银,成本较高,故C不选;
D.生成1mol硝酸铜,消耗2mol硝酸,成本低,没有有毒气体产生,故D选;
故选D.
点评 本题考查了铜和硝酸的性质,制备硝酸铜时应注意生产成本和环境污染,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 降温 | B. | 增大水蒸气的浓度 | ||
| C. | 增大C(s)的量 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
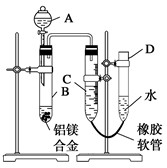 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ④ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com