
 取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.
取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL.| n |
| V |
| n |
| V |
| 0.0075mol |
| 0.05L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
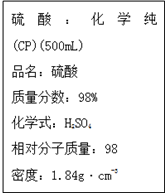 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中含有的乙酸杂质,可以加氢氧化钠溶液充分振荡后,分液 |
| B、用重结晶的方法分离苯甲酸和氯化钠的混合物 |
| C、将工业酒精直接蒸馏可以获得无水酒精 |
| D、用酸性高锰酸钾溶液可以除掉甲烷中的乙烯杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种元素所形成的酸的酸性:H3XO4>H3YO4 |
| B、两种元素所形成的气态氢化物的稳定性:XH3>YH3 |
| C、两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5 |
| D、两种元素所形成的气态氢化物的还原性:YH3>XH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
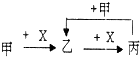 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合图.则甲和X不可能是( )| A、甲:Na、X:O2 |
| B、甲:NaOH溶液、X:CO2溶液 |
| C、甲:C、X:O2 |
| D、甲:AlCl3溶液、X:NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com