
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
分析 A.元素的非金属性越强,其氢化物的稳定性越强;
B.电子层数越多,其离子半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素.
解答 解:A.元素的非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>Br>I,则氢化物的稳定性HF>HCl>HBr>HI,故A正确;
B.电子层数越多,其离子半径越大;电子层结构相同的离子,离子半径随着原子序数增大而减小,钾离子有3个电子层,钠离子、镁离子、氯离子核外有2个电子层,且原子序数依次增大,所以微粒半径:K+>Na+>Mg2+>Al3+,故B正确;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P>Si,所以酸性:HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,则第一电离能Na<Al<Mg<Si,故D错误;
故选D.
点评 本题考查元素周期律,为高频考点,侧重考查学生判断及知识综合运用能力,明确同一周期、同一主族元素原子结构和性质递变规律是解本题关键,注意第一电离能大小比较的特殊情况,为易错点.


科目:高中化学 来源: 题型:实验题
 某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去).
某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去).| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解水生成氢气和氧气时,其能量转化主要是电能转化为化学能 | |
| B. | 某反应的反应物总能量低于生成物总能量,其能量转化主要是热能转化为化学能 | |
| C. | 大多数置换反应发生时,其能量转化主要是化学能转化为热能 | |
| D. | 铅蓄电池放电时,其能量转化主要是电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
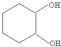 ,其过程如下:
,其过程如下: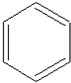 $→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→
$→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→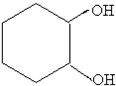
 ;
;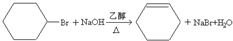 ;
; ;
;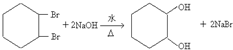 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜基态原子核外电子排布式为1s22s22p63s23p64s13d10 | |
| B. | 在d轨道中电子排布成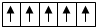 而不是 而不是 ,其最直接的根据是泡利原理 ,其最直接的根据是泡利原理 | |
| C. | 下列轨道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反应、激光、霓虹灯光等与原子核外电子发生跃迁释放能量有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下的可逆反应,反应物的转化率不可能达到100% | |
| B. | △H<0,△S>0的化学反应一定能自发进行 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol | |
| D. | 同一反应中,△H的大小与化学反应中参加反应的物质的量无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的乙醇溶液中分子总数为0.1NA | |
| B. | 常温常压下,28 g乙烯含有的电子数为16NA | |
| C. | 44g乙酸乙酯和丁酸的混合物中共含有碳原子数为2 NA | |
| D. | m g丙烯和戊烯的混合物中共用电子对数为$\frac{3m}{14}$NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
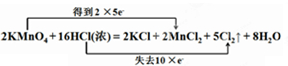 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com