
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) 0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= mol·L-1,c (H+) − c (MOH) = mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH 7(填“>、<或=”)。
【答案】(1) > (2)9.9×10-7 mol/L,1.0×10-8 mol/L。
(3)< c (Cl-)> c (M+)> c (H+)> c (OH-) (4) >
【解析】 (1)由混合溶液pH=6知反应生成的盐发生了水解,促进了水的电离,而酸抑制了水的电离,所以。混合溶液中由水电离出的c (H+) >0.2 mol·L-1 HCl溶液中由水电离出的c (H+) ;(2)c(H+)=10-6 mol/L,c(OH-)=10-8 mol/L,由电荷守恒关系可得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L。物料守恒:c(Cl-)=c(M+)+c(MOH),则c(H+)-c(MOH)=c(H+)-[c(Cl-)-c(M+)]=10-6 mol/L-9.9×10-7 mol/L=1.0×10-8 mol/L。(3)反应所得溶液为等物质的量浓度的MOH和MCl的混合液,只有MCl的水解程度大于MOH的电离程度时,才能pH<7。若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 <MCl的水解程度。溶液中各离子浓度由大到小的顺序为 。(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的Ph>7 。


科目:高中化学 来源: 题型:
下列事实对应的化学用语正确的是
A.金属钠加入滴有酚酞的水中,溶液变红:Na + 2H2O === Na+ + 2OH- + H2↑
B.用NaOH溶液吸收多余的氯气:Cl2 + 2OH- === Cl- + ClO-+ H2O
C.将NaHCO3溶液和过量Ca(OH)2溶液混合有白色沉淀:
2HCO3- + Ca2+ + 2OH- === CaCO3↓ + 2H2O + CO32-
D.将醋酸溶液滴到大理石上有气泡产生:2H+ + CaCO3 === CO2↑+ Ca2+ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:
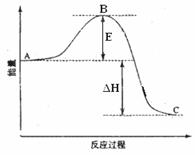
(1)图中A表示 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是 。
(2)已知单质硫的燃烧热为296 KJ·mol-1,计算由 S(s)生成3 molSO3(g)的△H(要求计算过程)。
S(s)生成3 molSO3(g)的△H(要求计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g) PCl5(g)达到平衡时,PCl5为0.80 mol,如果此时移走2.0 mol PCl3和1.0 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 ( )
PCl5(g)达到平衡时,PCl5为0.80 mol,如果此时移走2.0 mol PCl3和1.0 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是 ( )
A.0.8 mol B.0.4 mol C.小于0.4 mol D.大于0.4 mol,小于0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,20.00 mL硫酸和硝酸的混合溶液,加入足量的氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466 g沉淀。滤液跟2 mol/L NaOH溶液反应,用去10.00 mL碱液时恰好中和。下列说法中正确的是( )
A.原混合液中c(SO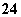 )=0.2 mol/L B.原混合液中c(NO
)=0.2 mol/L B.原混合液中c(NO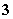 )=0.9 mol/L
)=0.9 mol/L
C.原混合液中pH=0 D.原混合液中由水电离出的c(H+)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机反应类型的说法错误的是( )
A.甲烷与氯气的反应属于取代反应
B.乙烯与氢气的反应属于加成反应
C.乙酸与乙醇的反应属于酯化反应
D.苯与硝酸的反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.制造水泥和普通玻璃的原料中都含有石灰石
B.普通玻璃是电的绝缘体,这种透明的固体物质熔点很低
C.石英玻璃能经受温度剧变且能抵抗酸碱的腐蚀
D.硅酸盐可用氧化物形式表示其组成,这表明硅酸盐是由氧化物组成的
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4- + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑ +8H2O
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
(1)如果研究催化剂对化学反应速率的影响,应使用实验 和 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验 和 。
(2)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 。
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体。
②将WgNa2C2O4配成100 mL标准溶液,量取20.00 mL置于锥形瓶中,
酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的浓度为________ (填表达式,用W表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com