
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是
A. 生石灰、白磷、熟石灰 B. 空气、氮气、胆矾
C. 干冰、铁、氯化氢 D. 烧碱、水银、碘酒
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】将4gNaOH和0.1mol Na2CO3混合并配成溶液,向溶液中滴加1.0molL﹣1稀盐酸.下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
B.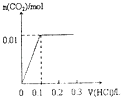
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质: ①蛋白质 ②脂类 ③糖类 ④无机盐 ⑤维生素 ⑥水.
其中属于人体需要的营养素有( )
A.①②③
B.①②③④
C.①②③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A.若管道漏气遇氨就会产生白烟B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2FeO4是一种高效多功能水处理剂。制备Na2FeO4的方法如下:2FeSO4+6Na2O2 =2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是( )
A. 还原剂与氧化剂物质的量之比为1:3
B. 每生成44.8L氧气就有4 mol Fe2+ 被氧化
C. 还原产物是Na2FeO4和Na2O
D. 1mol FeSO4发生反应时,反应中共有4 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
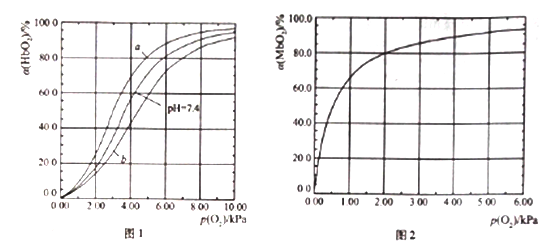
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) ![]() HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) ![]() MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=![]() ,计算37℃时K=____________。
,计算37℃时K=____________。
(6) Mb与氧气结合达平衡时结合度a=____________ [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物K可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示。

已知:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基
②醛能发生羟醛缩合反应,再脱水生成不饱和醛:

③
请回答:
(1)下列说法不正确的是_________________;
A.化合物A能与FeCl3发生显色反应
B.化合物C能够发生银镜反应
C.I转化为J属于加成反应
D.K与足量NaOH溶液反应时,1molK最多可消耗3molNaOH
(2)化合物D的结构简式为_____________________________________;
(3)E→F的化学方程式为____________________________________________;
(4)G也可以与环氧丙烷(![]() )发生类似反应G+J→K的反应,其生成物的结构简式为_____________________(写一种);
)发生类似反应G+J→K的反应,其生成物的结构简式为_____________________(写一种);
(5)写出符合下列条件的A的所有同分异构体的结构简式___________________;
①能与氯化铁溶液发生显色反应
②1H-NMR谱显示分子中苯环上有两种不同化学环境的氢原子
(6)通常采用有机物H为原料合成有机物I,请设计该合成路线_________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:

已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是( )
A.二氧化碳和干冰互为同素异形体
B.金刚石是碳的一种同位素
C.C60与金刚石一样属于原子晶体
D.水结冰体积膨胀、密度变小,这一事实与水中存在氢键有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com