
ʵ���ҽ����к��Ȳⶨ��ʵ��ʱ����Ҫ���ձ���500mL����С�ձ���100mL���⣬���õ������������Լ�����ȷ��һ���ǣ���
A�� 0.50 mol•L﹣1���ᣬ0.50 mol•L﹣1NaOH��Һ��100 mL��Ͳ1��
B�� 0.50 mol•L﹣1���ᣬ0.55 mol•L﹣1NaOH��Һ��100 mL��Ͳ2��
C�� 0.50 mol•L﹣1���ᣬ0.55 mol•L﹣1NaOH��Һ��50 mL��Ͳ1��
D�� 0.50 mol•L﹣1���ᣬ0.55 mol•L﹣1NaOH��Һ��50 mL��Ͳ2��
���㣺 �к��ȵIJⶨ��
ר�⣺ ��ѧʵ�鳣��������
������ ����ʵ���ҽ����к��Ȳⶨ��ʵ����Ҫ�����������ձ���500 mL����С�ձ���100 mL�����¶ȼơ���Ͳ��50 mL����������ĭ���ϻ�ֽ������ĭ���ϰ��Ӳֽ�壨����������С�ף������β����������0.50 mol/L ���ᡢ0.55 mol/L NaOH��Һ��
��� �⣺ʵ���ҽ����к��Ȳⶨ��ʵ����Ҫ�����������ձ���500 mL����С�ձ���100 mL�����¶ȼơ���Ͳ��50 mL����������ĭ���ϻ�ֽ������ĭ���ϰ��Ӳֽ�壨����������С�ף������β����������0.50 mol/L ���ᡢ0.55 mol/L NaOH��Һ��
��ѡ��D��
������ ������Ҫ�������к��Ȳⶨ������ѡ����Ŀ�ѶȲ���ע�����ղⶨ�к��ȵ���ȷ������


 ��������������������ϵ�д�
��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪2H2��g��+O2��g��═2H2O��l����H=﹣571.6kJ•mol﹣1 CO��g��+ O2��g��=CO2��g����H=﹣283kJ•mol﹣1ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74kJ������ͬʱ����3.6gҺ̬ˮ����ԭ���������H2��CO�����ʵ�����
O2��g��=CO2��g����H=﹣283kJ•mol﹣1ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74kJ������ͬʱ����3.6gҺ̬ˮ����ԭ���������H2��CO�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʾ����H1=﹣393.5kJ•mol﹣1����H2=﹣395.4kJ•mol﹣1������˵�����ʾʽ��ȷ���ǣ���
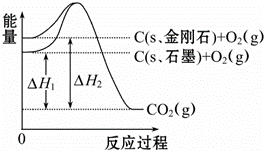
A�� C��s��ʯī��═C��s�����ʯ����H=+1.9 kJ•mol﹣1
B�� ʯī�ͽ��ʯ��ת���������仯
C�� ���ʯ���ȶ���ǿ��ʯī
D�� 1 molʯī��������1 mol���ʯ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ȼ�ѧ����ʽ��2H2��g��+02��g��=2H20��1������H=﹣571.6kJ•mol﹣1�������й���������ȷ���ǣ���
A�� 2mol H2��ȫȼ������Һ̬ˮʱ�ų�571.6 kJ����
B�� 1mol H2��ȫȼ������Һ̬ˮʱ�ų�285.8kJ����
C�� 2���������ȫȼ������Һ̬ˮʱ�ų�571.6 kJ����
D�� �����Ȼ�ѧ����ʽ�ɱ�ʾΪH2��g��+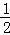 O2��g��=H20��1������H=﹣285.8 kJ•mol﹣1
O2��g��=H20��1������H=﹣285.8 kJ•mol﹣1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�ܱ������з������·�Ӧ��X��g��+3Y��g��2Z��g����H��0����ͼ��ʾ�÷�Ӧ�����ʣ��ԣ���ʱ�䣨t���仯�Ĺ�ϵ��t2��t3��t5ʱ��������������ı䣬����û�иı�����ʵij�ʼ������������˵������ȷ���ǣ���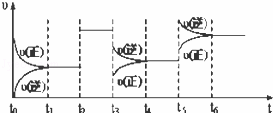
A�� t3ʱ�������¶�
B�� t5ʱ������ѹǿ
C�� t2ʱ�����˴���
D�� t4��t5ʱ����ת����һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ��
��1����25�桢101kPa�£�16g�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ ��
��2����ѧ��Ӧ�зų������ܣ��ʱ䣬��H���뷴Ӧ���������ļ��ܣ�E���йأ�
��֪��H2 ��g��+Cl2 ��g��=2HCl ��g����H=﹣185kJ/molE��H﹣H��=436kJ/mol E��Cl﹣Cl��=243kJ/mol��E��H﹣Cl��=
��3������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����֪��
2Cu��s��+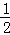 O2��g��═Cu2O��s����H=﹣169kJ•mol﹣1��
O2��g��═Cu2O��s����H=﹣169kJ•mol﹣1��
C��s��+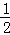 O2��g��═CO��g����H=﹣110.5kJ•mol﹣1��
O2��g��═CO��g����H=﹣110.5kJ•mol﹣1��
2Cu��s��+O2��g��═2CuO��s����H=﹣314kJ•mol﹣1
��ҵ����̿���ڸ��������»�ԭCuO��ȡCu2O��CO���Ȼ�ѧ����ʽΪ ��
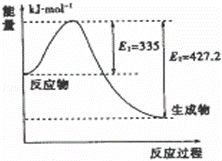
��4������ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ�������ÿ����1mol NH3�ų�����Ϊ�� ��
������ʼʱ�������ڷ���1mol N2��3mol H2����ƽ���N2��ת����Ϊ20%����Ӧ�ų�������ΪQ1 kJ����Q1����ֵΪ ������ͬ����������г���2mol N2��6mol H2����ƽ���ų�������ΪQ2 kJ����Q2 2Q1�����������������=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ����ʽ������� (����)��
A��Ca(HCO3)2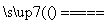 CaCO3����CO2����H2O
CaCO3����CO2����H2O
B��Mg(HCO3)2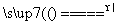 MgCO3����CO2����H2O
MgCO3����CO2����H2O
C��MgCO3��H2O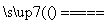 Mg(OH)2����CO2��
Mg(OH)2����CO2��
D��CaCO3��H2O===Ca(OH)2��CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и������ﲻ���ɵ���ֱ�ӻ�����ȡ���ǣ���
A�� HCl B�� FeCl2 C�� AlCl3 D�� CuCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Һ��Cl﹣�����ʵ���Ũ����100ml 1mol•L﹣1AlCl3��Һ��Cl﹣��ȵ��ǣ���
A�� 150ml 1 mol•L﹣1�Ȼ�����Һ
B�� 75ml 2 mol•L﹣1�Ȼ�þ��Һ
C�� 50ml 3mol•L﹣1�Ȼ�����Һ
D�� 200ml 1.5 mol•L﹣1�Ȼ�����Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com