
【题目】等质量的CH4和NH3比较,下列结论错误的是:
A.分子个数之比为17:16 B.原子个数之比为17:16
C.氢原子个数之比为17:12 D.所含氢原子质量之比为17:12
【答案】B
【解析】
试题分析:A、根据N=![]() NA知,质量相同的两种气体中含有的分子个数之比等于摩尔之比的反比,所以两份质量相同的CH4和NH3的分子数之比为17:16,故A正确;B、CH4和NH3的分子含有的原子数分别为5、4,由A知两份质量相同的CH4和NH3的分子数之比为17:16,所以含有的原子数之比为17×5:16×4=85:64,故B错误;C、CH4和NH3的分子含有的H原子数分别为4、3,由A知两份质量相同的CH4和NH3的分子数之比为17:16,所以含有的H原子数之比为17×4:16×3=17:12,故C正确;D、由C可知两份质量相同的CH4和NH3所以含有的H原子数之比为17:12,H原子数目之比等于H原子质量之比为17:12,故D正确;故选B。
NA知,质量相同的两种气体中含有的分子个数之比等于摩尔之比的反比,所以两份质量相同的CH4和NH3的分子数之比为17:16,故A正确;B、CH4和NH3的分子含有的原子数分别为5、4,由A知两份质量相同的CH4和NH3的分子数之比为17:16,所以含有的原子数之比为17×5:16×4=85:64,故B错误;C、CH4和NH3的分子含有的H原子数分别为4、3,由A知两份质量相同的CH4和NH3的分子数之比为17:16,所以含有的H原子数之比为17×4:16×3=17:12,故C正确;D、由C可知两份质量相同的CH4和NH3所以含有的H原子数之比为17:12,H原子数目之比等于H原子质量之比为17:12,故D正确;故选B。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】下列相关家庭实验能达到预期目的的是 ( )
相关实验 | 预期目的 | |
A. | 在少量食用碱中一次性加入过量食醋 | 探究食用碱是碳酸钠还是碳酸氢钠 |
B. | 在食用盐中滴加少量淀粉液 | 探究食用盐是否为加碘盐 |
C. | 用激光笔照射淀粉液 | 探究淀粉液是胶体还是溶液 |
D | 将鸡蛋白溶于水后,滴加AgNO3溶液 | 验证蛋白质中含有氯元素 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有A、B、C、D四种化合物,分别由K+、Ba2+、SO42-、CO32-、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断B的化学式。_______________
(2)写出下列反应的离子方程式。
B与盐酸反应:____________________
E(少量)与澄清石灰水反应:___________________
Ⅱ.某气体的分子为双原子分子, 其摩尔质量为Mg/mol,现有标准状况下VL该气体,设阿伏加德罗常数为NA,则
(1)①该气体的物质的量为____________mol;
②该气体在标准状况下的密度为___________g·L-1;
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10mLA受热分解生成15mLO2和10mLF2,则A的化学式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量的N02,发生反应2N02(g)![]() N204(g) △H=一57kJ·mol—1。在温度为T1、T2时,平衡体系中N02的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
N204(g) △H=一57kJ·mol—1。在温度为T1、T2时,平衡体系中N02的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
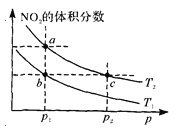
A.a、c两点的反应速率:a>c
B.a、b两点N02的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学反应的离子方程式,其中正确的是:
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-![]() NH3↑+SO32-+2H2O
NH3↑+SO32-+2H2O
B.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.大理石溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“>”或“<”填空:
(1)键长:N-N_____N=N
(2)键能:2E(C-C)_____E(C=C)
(3)键角:CO2_____SO2;
(4)键的极性:C-H_____N-H。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二猛(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
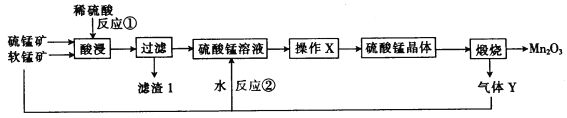
(1)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为___________。
(2)操作X为蒸发浓缩、_____________、洗涤烘干。经操作X之后得到MnSO4 H2O。在洗涤操作中,常用酒精洗涤MnSO4 H2O晶体,主要目的是_________________。
(3) 气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为____________。
(4) Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为___________。
(5)用标准的BaCl2溶液测定样品中MnSO4 H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是__________(任写一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成C的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com