
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是工业上从铝土矿(主要成分是Al2O3,含有少量SiO2、Fe2O3等杂质)中生产铝的工艺流程:
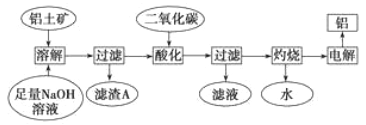
据此回答下列问题:
(1)电解制取铝的化学反应中,反应物的键能之和_____生成物的键能之和(填“大于”、“小于”或“等于”)。
(2)铝土矿中绝大部分成分都可以溶解在NaOH溶液中。请根据周期表对角线规则写出铍的氧化物与NaOH溶液反应的离子方程式:______________。
(3)滤渣A的主要成分____________。
(4)在工艺流程第三步中,通入过量二氧化碳所发生反应的化学方程式_______________。
(5)某同学在实验室模拟工业生产铝,称取ag铝土矿可制得bgAl(儇设每步反应进行完全),则铝土矿中Al2O3的质量分数为____________。
【答案】 大于 BeO+2OH-= BeO22-+ H2O Fe2O3 NaAlO2+CO2+2H2O= AlOH)3↓+ NaHCO3 ![]()
【解析】本题考查化学工艺流程,(1)电解氧化铝,此反应类型属于分解反应,属于吸热反应,即反应物的键能总和大于生成物的键能总和;(2)Be与铝元素处于对角线,氧化铝与氢氧化钠反应生成偏铝酸钠和水,即BeO+2OH-=BeO22-+H2O;(3)氧化铁是碱性氧化物,不与NaOH溶液反应,氧化铝是两性氧化物,SiO2是酸性氧化物,都与NaOH溶液反应,因此滤渣为Fe2O3;(4)第二步过滤,得到滤液中含有SiO32-和AlO2-,又因为碳酸的酸性强于硅酸和偏铝酸,因此发生的反应是SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(5)题目中,每步反应进行完全,因此根据铝元素守恒,即n(Al2O3)=b/54mol,因此m(Al2O3)=102b/54mol=17b/9mol,其质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】X、Y、.Z三种短周期元素在周期表中的位置如下图,X元素的单质是空气中含量最高的气体,下列说法不正确的是 ( )
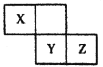
A. X元素韵氢化物和其最高价氧化物对应水化物易发生反应
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. Z的气态氢化物比y的气态氢化物更加稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验(如图)。
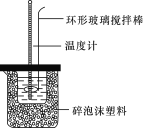
(1)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还应加入的试剂是________(填序号)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(2)在实验过程中,该同学需要测定并记录的实验数据有_____________(填序号)。
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.溶液混合后的最高温度
(3)若用50 mL 0.5 mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据_____________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(s)![]() C(g);ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“减慢”或“不变”):
C(g);ΔH<0,在其他条件不变时,改变其中一个条件,则生成C的速率(填“加快”、“减慢”或“不变”):
(1)升温__________;
(2)加正催化剂__________;
(3)增大容器容积__________;
(4)加入A__________;
(5)加入C__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色强酸性溶液中,下列各组离子能大量共存的是( )
A. Na+、Fe3+、SO42﹣、Cl﹣ B. Na+、K+、NH4+、Cl﹣
C. Ca2+、K+、NO3﹣、CH3COO﹣ D. K+、Na+、I﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.液态氯化氢、固体氯化钾均不导电,故HCl和KCl均为非电解质
B.SO2、SO3水溶液都能导电,故二者均为电解质
C.铜和石墨均能导电,所以它们都是电解质
D.蔗糖、乙醇在水溶液中和熔融状态下都不导电,所以它们是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于“0”刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;
④ 向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
向锥形瓶中滴入几滴酚酞作指示剂,进行滴定,测出所耗硫酸的体积;
⑤重复以上过程。
试回答下列问题:
(1)当滴入最后一滴稀硫酸时,____________________,可判断达到滴定终点。
(2)滴定过程中,下列会导致滴定结果偏低的是( )
A、若记录读数时,起始时仰视,终点时俯视
B、滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常
C、若配制硫酸时,定容时俯视刻度,其他操作正常
D、酸式滴定管在装酸液前未用待测硫酸溶液润洗
E、开始实验时碱式滴定管尖嘴部分有气泡,滴定结束气泡消失
(3)测定操作中有一步存在问题,该步骤是:__________________(填序号)
(4)根据下列数据:
滴定次数 | 待测液体积(mL) | 标准硫酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.50 | 25.45 |
第二次 | 20.00 | 4.00 | 29.05 |
第三次 | 20.00 | 3.00 | 30.00 |
第四次 | 20.00 | 2.00 | 27.00 |
请计算待测烧碱溶液的浓度为 mol/L。
(5)为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0 g,置于锥形瓶中,加50 mL水,再加入2 g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10 min,加入3 mL 0.5%淀粉溶液并稀释成250ml溶液,取25ml该溶液,用0.010 0 mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00 mL,则上述产品中(NH4)2Cr2O7的纯度为 。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com