
| A. | ①②③④ | B. | ①②③④⑦ | C. | ①②④⑦ | D. | ①②③④⑤⑥⑦ |
分析 氧化还原反应的特征是元素化合价的变化,如发生氧化还原反应,则一定存在元素化合价的变化,结合具体的反应进行判断.
解答 解:①N和O元素化合价变化,属于氧化还原反应,故正确;
②N和O元素化合价变化,属于氧化还原反应,故正确;
③N元素化合价变化,由+4价分别变化为+5价和+2价,属于氧化还原反应,故正确;
④S和O元素化合价发生变化,属于氧化还原反应,故正确;
⑤元素化合价没有发生变化,不是氧化还原反应,故错误;
⑥元素化合价没有发生变化,不是氧化还原反应,故错误;
⑦元素化合价没有发生变化,不是氧化还原反应,故错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和基本概念的理解和运用的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.


科目:高中化学 来源: 题型:解答题
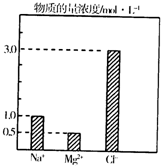 金属及其化合物有广泛的应用.
金属及其化合物有广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
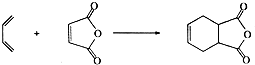
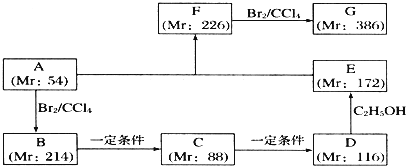
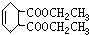 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 40mL | C. | 50mL | D. | 30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
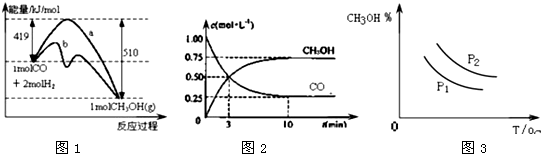
| A. | CO和H2合成CH3OH的反应:△H<0,△S<0 | |
| B. | 保持温度不变,再充入1molCO和2molH2,反应达到新平衡时$\frac{n(CHOH)}{n(CO)}$减小 | |
| C. | 图1中曲线b可表示使用了催化剂的能量变化情况 | |
| D. | 图3中曲线可表示在不同压强P1、P2(P1<P2)条件下甲醇百分含量随温度变化的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(I);△H=-57.3kJ•mol-1molCH3COOH的稀溶液与含l mol NaOH的稀溶液混合,放出的热量小于57.3 kJ | |
| C. | 由C(石墨)=(金刚石);△H=+1.90kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | 500℃、30MPa下,将0.5 mol(g)和1.5 mol (g)置于密闭容器中充分反应生成(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g);△H=-38.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com