
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下,4g CH4含0.25 NA个C-H共价键
B.1mol冰醋酸和1mol乙醇反应生成的水分子数目为NA
C.标准状况下,33.6 L二氯甲烷中含有氯原子的数目为3NA
D.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届内蒙古赤峰市宁城县高三上统一考试化学试卷(解析版) 题型:填空题
氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下:
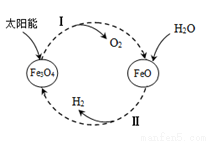
(1)过程Ⅰ:2Fe3O4(s)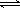 6FeO(s)+O2(g) ΔH=+313.18 kJ/mol
6FeO(s)+O2(g) ΔH=+313.18 kJ/mol
① 将O2分离出去,目的是提高Fe3O4的__________________。
② 平衡常数K随温度变化的关系是 。
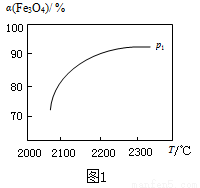
③ 在压强p1下,Fe3O4的平衡转化率随温度变化的α(Fe3O4)~T曲线如图1所示。若将压强由p1增大到p2,在图1中画出p2的α(Fe3O4)~T曲线示意图。
(2)过程Ⅱ的化学方程式是 。
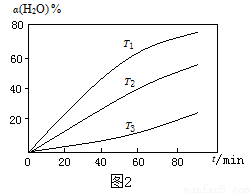
(3)过程Ⅱ,其他条件不变时,在不同温度下,H2O的转化率随时间的变化α(H2O)~t 曲线如图2所示。比较温度T1、T2、T3的大小关系是 ,判断依据是  。
。
(4)科研人员研制出透氧膜(OTM),它允许电子、O2-同时透过,可实现水连续分解制H2。工作时,CO、H2O分别在透氧膜的两侧反应。工作原理示意图如下:
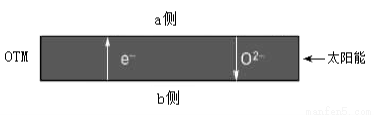
H2O在___________侧反应(填“a”或 “b”),在该侧H2O释放出H2的反应式是 。
“b”),在该侧H2O释放出H2的反应式是 。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省六校协作体高三上学期期中化学试卷(解析版) 题型:选择题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C. 30 mL D.15 mL
30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省六校协作体高三上学期期中化学试卷(解析版) 题型:选择题
一定量的浓硫酸跟过量的锌充分反应,产生的气体可能有
① SO2 ② SO3 ③ H2S ④ H2
A.①②③ B.①③④ C.①②④ D.只有①
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三10月月考化学卷(解析版) 题型:选择题
下列装置、操作能达到目的或实验现象正确的是( )
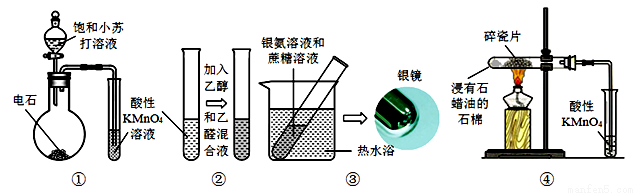
A.装置①:制取乙炔并验证炔烃的性质
B.装置②:检验乙醛的还原性,溶液颜色从紫红色变无色
C.装置③:产生银镜,说明蔗糖分子中含有醛基官能团
D.装置④:酸性KMnO4溶液中出现气泡且逐渐褪色,说明有不同于烷烃的另一类烃产生
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:推断题
下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中,B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
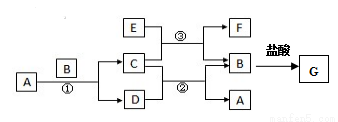
(1)C的化学式 ,C与足量盐酸反应的离子方程式 ;
(2)反应③化学方程式 ;E加入过量的NaOH溶液对应离子反应方程式 ;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式 ;
(4)纯净G的溶液中金属阳离子检验方法 ;向G溶液中加入NaOH溶液后的现象是 ;反应的化学方程式为 ;
(5)F与氢氧化钠反应的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
下列说法中正确的是( )
A.分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.将Fe(OH)3放入表面皿中,加入足量盐酸,将反应后的溶液加热蒸干、灼烧得到Fe2O3
D.Al(OH)3中混有Mg(OH)2加入足量烧碱溶液,充分反应过滤,向滤液中加入足量盐酸后过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
下列说法不正确的是( )
A.当7.8 g Na2O2与H2O完全反应时,有0.1 mol电子发生了转移
B.FeCl2溶液与NaOH溶液混合,利用此反应可检验Fe2+
C.用浓盐酸酸化KMnO4溶液以增强其氧化性
D.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量 比为1:2
比为1:2
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:实验题
氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.其制备反应原理为:Al2O3+N2+3C═2AlN+3CO.制备过程中,原料配比不当或反应不完全等因素都会造成产品中含有碳或Al2O3等杂质.为测定产品中AlN的质量分数,某同学按如图1装置进行相关实验.可选用的化学试剂为:mg氮化铝片状固体、NaOH饱和溶液、水、煤油、医用酒精.回答下列问题:
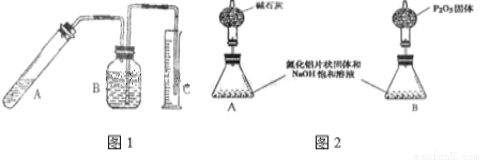
(1)组装完实验装置,使用前第一步应该
(2)图1(B)中试剂最好选用 (填序号):
①煤油 ② 医用酒精 ③水
医用酒精 ③水
已知A 中有NaAlO2生成,并放出有刺激性气味气体,写出A中发生反应的离子方程式 .
(3)读取C(量筒)中液体体积时,应注意下列问题,错误的是 (填序号)
a.C中液面不再上升时立即读数
b.上下移动C,使之液面与B中液面相平
c.A中不再有气泡逸出
d.视线与凹液面最低处相平
(4)mg氮化铝与足量NaOH饱和溶液反应,实验结束后,C中收集到液体的体积为VL(已折算成标准状况),则AlN样品的纯度为 (写计算表达式).
(5)上述实验方案,可能因气体体积测量不准,导致误差较大.有人建议改用下列A、B两个装置中的一种(在通风橱内进行),只需进行简单而又必要的数据测写,用差量法就可比较准确确定样品中AlN的质量分数.较合理的装置是: (填代号).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com