
| 445 |
| 0.5 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��N2�ĵ���ʽ�� |
| B��CO2�ĵ���ʽ��O����C����O�� |
C��NaCl�ĵ���ʽ�� |
D��F-�Ľṹʾ��ͼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����FeCl2��Һ��ͨ��Cl2��2Fe2++Cl2=2Fe3++2Cl- |
| B��Ba��OH��2��Һ������ķ�Ӧ��OH-+H+=H2O |
| C����Al��OH�� 3�еμ����Al��OH�� 3+3H+=Al3++3H2O |
| D����������ˮ��Ӧ��Na+H2O=Na++OH-+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���Ȼ�ѧ����ʽδע���¶Ⱥ�ѹǿʱ����H��ʾ��״���µ����� |
| B���Ȼ�ѧ����ʽ�еĻ�ѧ������ֻ������Ӧ�������������ʵ��� |
| C���ڼ��Ȼ��ȼ�����²��ܽ��еĻ�ѧ��Ӧ�ȿ���Ϊ���ȷ�Ӧ��Ҳ����Ϊ���ȷ�Ӧ |
| D��ͬһ��ѧ��Ӧ��ѧ��������ͬ����Hֵ��ͬ����ѧ��������ͬ��״̬��ͬ����HֵҲ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������������д����Ӧ���Ȼ�ѧ����ʽ��
������������д����Ӧ���Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ռ���Һ | B�������¶� |
| C�������������� | D����ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
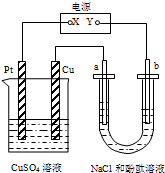 ��ͼ��ʾװ���У�a��b���Ƕ��Ե缫��ͨ��һ��ʱ���b��������Һ�ʺ�ɫ����
��ͼ��ʾװ���У�a��b���Ƕ��Ե缫��ͨ��һ��ʱ���b��������Һ�ʺ�ɫ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com