
| A. | 原氨水物质的量浓度为0.1mol•L-1 | |
| B. | 反应后的溶液中c(NH+4)+c (NH3•H2O)+c(NH3)=0.1mol•L-1 | |
| C. | 反应后的溶液中:c(Cl-)>c(NH+4)>c(H+)>c( OH-) | |
| D. | 原氨水中:c(NH+4)+c(H+)=c(OH-) |
分析 pH=1的盐酸,其浓度为0.1mol/L,而pH=11的氨水浓度大于0.001mol/L,二者等体积混合恰好反应说明生成氯化铵,二者浓度相等,结合物料守恒和电荷守恒分析解答.
解答 解:A.二者等体积混合恰好反应说明二者物质的量浓度相等,则原氨水物质的量浓度为0.1mol•L-1,故A正确;
B.混合溶液与原氨水体积相比,体积增大一倍,所以根据物料守恒得c(NH4+)+c(NH3•H2O)+c(NH3)=0.05 mol•L-1,故B错误;
C.氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,所以c(H+)>c(OH-),根据电荷守恒得c(H+)+c(NH4+)=c(OH-)+c(Cl-),所以得c(NH4+)<c(Cl-),盐溶液中铵根离子水解较微弱,所以c(NH4+)>c(H+)则离子浓度大小顺序是c(Cl-)>c(NH+4)>c(H+)>c( OH-),故C正确;
D.任何溶液中都存在电荷守恒,所以原氨水溶液中存在电荷守恒c(NH+4)+c(H+)=c(OH-),故D正确;
故选B.
点评 本题考查酸碱混合的计算,为高频考点,把握酸碱恰好反应时生成氯化铵判断浓度关系为解答的关键,侧重分析与应用能力的考查,注意盐类水解及电荷守恒应用,题目难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | 元素X、Y组成的化合物只有两种 | |
| C. | W的简单气态氢化物的热稳定性比Y的弱 | |
| D. | Q、Z的简单离子具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. | 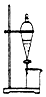 用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Li | Be | B | C | O | F |
| X值 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| X值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
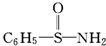 ,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).
,在S~N中,你认为共用电子对偏向谁?氮(写原子名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )| A. | 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 | |
| B. | 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 | |
| C. | 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)>c(A-)>c(H+)>c(OH-) | |
| D. | 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2都是酸性氧化物,分别能形成硫酸型酸雨和硝酸型酸雨 | |
| B. | 明矾[KAl(SO4)2•l2H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| C. | 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点 | |
| D. | 日常生活中常用汽油去除衣物上的油污,用热的纯碱溶液洗涤炊具上的油污,两者的原理完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于第二周期 IIIA族 | |
| B. | 核外有3种能量不同的电子 | |
| C. | 最外层电子占据3个轨道 | |
| D. | 最外层上有3种运动状态不同的电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com