
| A. | 酸式滴定管只用水洗 | |
| B. | 锥形瓶只用水洗 | |
| C. | 使用甲基橙做指示剂 | |
| D. | 第一次观察酸式滴定管的刻度时仰视 |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A、酸式滴定管只用水洗,注入标准溶液盐酸后,标准液的浓度偏小,造成V(标)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,则c(待测)偏大,故A错误;
B、锥形瓶只用水洗,待测液的物质的量无影响,V(标)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,则c(待测)不变,故B错误;
C、使用甲基橙做指示剂,甲基橙在酸性范围内变色,造成V(标)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$,则c(待测)偏大,故C错误;
D、若第一次观察酸式滴定管的刻度时仰视,结束后观察酸式滴定管的刻度时平视,造成V(标)偏小,由c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知,c(待测)偏小,故D正确;
故选:D.
点评 本题主要考查了中和滴定操作的误差分析,难度不大,注意把握误差分析的方法,侧重于考查学生的分析能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
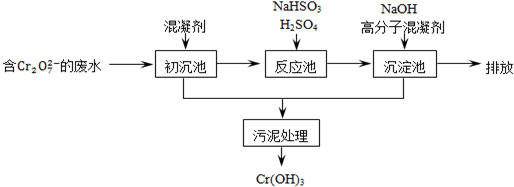
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
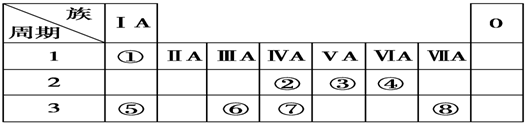
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com