


| Br2,红磷 |

| 苯酚钠 |
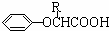
| HBr,过氧化物 |
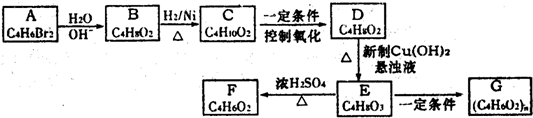
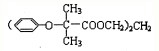 可知,合成双安妥明的物质为HOCH2CH2CH2OH、
可知,合成双安妥明的物质为HOCH2CH2CH2OH、 .I的分子式为C3H4O,经过系列反应生成K,根据C原子数目可知,K为HOCH2CH2CH2OH,Ⅰ能发生银镜反应,分子中含有-CHO,且1molI能与2mol氢气发生加成反应,说明分子中还含有C=C双键,故I为CH2=CH-CHO,J为HOCH2CH2CHO,H为
.I的分子式为C3H4O,经过系列反应生成K,根据C原子数目可知,K为HOCH2CH2CH2OH,Ⅰ能发生银镜反应,分子中含有-CHO,且1molI能与2mol氢气发生加成反应,说明分子中还含有C=C双键,故I为CH2=CH-CHO,J为HOCH2CH2CHO,H为 .B与G反应生成
.B与G反应生成 ,由反应信息Ⅰ可知,合成H的物质为苯酚钠、BrC(CH3)2COOH,C的分子式为C4H8,经过系列转化生成G,根据C原子数目可知,G为BrC(CH3)2COOH,故B为苯酚钠,A与氢氧化钠反应生成B,故A为苯酚
,由反应信息Ⅰ可知,合成H的物质为苯酚钠、BrC(CH3)2COOH,C的分子式为C4H8,经过系列转化生成G,根据C原子数目可知,G为BrC(CH3)2COOH,故B为苯酚钠,A与氢氧化钠反应生成B,故A为苯酚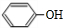 ;F在溴/红磷作用下生成G,根据反应信息Ⅰ,可知F为CH(CH3)2COOH,E连续氧化生成F,故E为CH(CH3)2CH2OH,D转化生成E,D为CH(CH3)2CH2Br,由反应信息Ⅱ可知,C为CH(CH3)2=CH2,据此解答.
;F在溴/红磷作用下生成G,根据反应信息Ⅰ,可知F为CH(CH3)2COOH,E连续氧化生成F,故E为CH(CH3)2CH2OH,D转化生成E,D为CH(CH3)2CH2Br,由反应信息Ⅱ可知,C为CH(CH3)2=CH2,据此解答. 可知,合成双安妥明的物质为HOCH2CH2CH2OH、
可知,合成双安妥明的物质为HOCH2CH2CH2OH、 .I的分子式为C3H4O,经过系列反应生成K,根据C原子数目可知,K为HOCH2CH2CH2OH,Ⅰ能发生银镜反应,分子中含有-CHO,且1molI能与2mol氢气发生加成反应,说明分子中还含有C=C双键,故I为CH2=CH-CHO,J为HOCH2CH2CHO,H为
.I的分子式为C3H4O,经过系列反应生成K,根据C原子数目可知,K为HOCH2CH2CH2OH,Ⅰ能发生银镜反应,分子中含有-CHO,且1molI能与2mol氢气发生加成反应,说明分子中还含有C=C双键,故I为CH2=CH-CHO,J为HOCH2CH2CHO,H为 .B与G反应生成
.B与G反应生成 ,由反应信息Ⅰ可知,合成H的物质为苯酚钠、BrC(CH3)2COOH,C的分子式为C4H8,经过系列转化生成G,根据C原子数目可知,G为BrC(CH3)2COOH,故B为苯酚钠,A与氢氧化钠反应生成B,故A为苯酚
,由反应信息Ⅰ可知,合成H的物质为苯酚钠、BrC(CH3)2COOH,C的分子式为C4H8,经过系列转化生成G,根据C原子数目可知,G为BrC(CH3)2COOH,故B为苯酚钠,A与氢氧化钠反应生成B,故A为苯酚 ;F在溴/红磷作用下生成G,根据反应信息Ⅰ,可知F为CH(CH3)2COOH,E连续氧化生成F,故E为CH(CH3)2CH2OH,D转化生成E,D为CH(CH3)2CH2Br,由反应信息Ⅱ可知,C为CH(CH3)2=CH2,
;F在溴/红磷作用下生成G,根据反应信息Ⅰ,可知F为CH(CH3)2COOH,E连续氧化生成F,故E为CH(CH3)2CH2OH,D转化生成E,D为CH(CH3)2CH2Br,由反应信息Ⅱ可知,C为CH(CH3)2=CH2, ,可知其分子式为C23H28O6,J为HOCH2CH2CHO,含有官能团有:羟基、醛基,
,可知其分子式为C23H28O6,J为HOCH2CH2CHO,含有官能团有:羟基、醛基,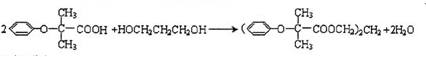 ,
, ;
;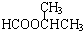 、CH3HCOOCH2CH3、CH3CH2HCOOCH3,故符合条件的同分异构体共有4种,
、CH3HCOOCH2CH3、CH3CH2HCOOCH3,故符合条件的同分异构体共有4种,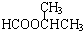 、CH3CH2HCOOCH3.
、CH3CH2HCOOCH3.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
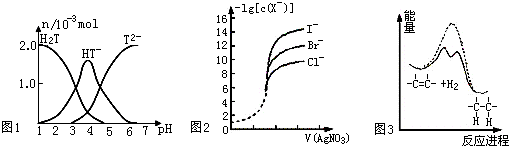
| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
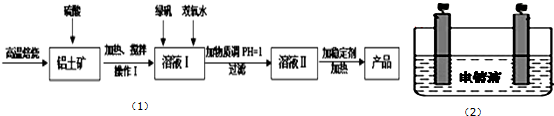
查看答案和解析>>
科目:高中化学 来源: 题型:
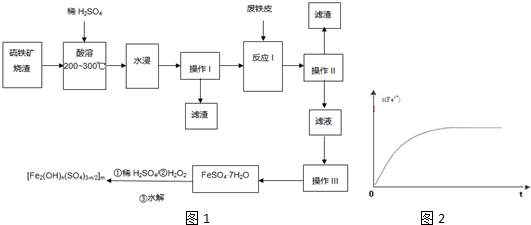
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| B、在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
| C、在试管中将一定量的浓硝酸,浓硫酸和苯混合,用酒精灯直接加热几分钟,即可制得硝基苯 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com