
mg铜与足量浓H2SO4共热时完全反应,在标准状况下生成nL气体,则被还原的H2SO4的量是( )
A.m/32mol B.m/64mol C.98n/22.4g D.196n/22.4g
科目:高中化学 来源:2016-2017学年湖北省高二上开学测化学试卷(解析版) 题型:选择题
分子式为C4H8Cl2的有机物共有(不含立体异构)
A. 7种 B.8种 C.9种  D.10种
D.10种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:填空题
已知体积为2L的恒容密闭容器中发生反应:2SO2(g) + O2(g) 2SO3(g),请根据化学反应的有关原理同答下列问题
2SO3(g),请根据化学反应的有关原理同答下列问题
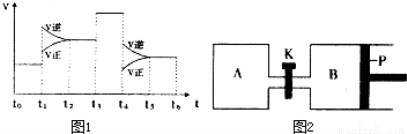
(1)一定条件下,充入2mol SO2(g)和2mol O2(g),20s后,测得SO2的体积百分含量为12.5%,则用SO2表示该反应在这20s内的反应速 率为_____________________。
率为_____________________。
(2)下面的叙述可作为判断(1)中可逆反应达到平衡状态依据的是(填序号)___________。
①混合气体的密度不变 ②混合气体的平均相对分子质量不变
③ v正(SO2)=2v正(O2) ④各气体的浓度都不再发生变化
(3)图1表示该反应的速率(v)随时间(t)的变化的关系.则下列不同时间段中,SO3 的百分含量最高的是( )
A、t2→t3 B、t0→t1 C、t5→t6 D、t3→t4
据图分析:你认为t3时改变的外界条件可能是__________;
(4)图2中P是可自由平行滑动的活塞.在相同温度时,向A容器中充入4mol SO3(g),关闭K,向B容器中充入2mol SO3(g),两容器分别发生反应.已知起始时容器A和B的体积均为aL。试回答:
①反应达到平衡时容器B的体 积
积 为1.2a L,容器B中SO3转化率为___________。
为1.2a L,容器B中SO3转化率为___________。
②若打开K,一段时间后重新达到平衡,容器B的体积为___________L(连通管中气体体积忽略不计,且不考虑温度的影响)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
将硫化氢通入碘水中发生反应,其化学方程式为H2S+I2=S+2HI,由此推断出下列结论错误的是( )
A.硫是比碘强的还原剂 B.硫比碘更容易得到电子
C.碘是比硫较强的氧化剂 D.硫离子比碘离子更容易失电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
下列有关物质性质应用的说法正确的是( )
A.SO2具有漂白性,可用作熏蒸粉丝使其增白
B.常温下,二氧化硅不与强酸反应,可用石英容器盛放氢氟酸
C.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
D.氧化铝熔点很高,可制造高温耐火材料,如制耐火管、坩埚等
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第五次周练化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下图。

已知以下信息:

③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是________,X与HCN反应生成A的反应类型是_________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是_____________。
(3)X发生银镜反应的化学方程式是______________________。
(4)G在NaOH溶液中发生水解反应的化学方程式是__________________。
(5) 的同分异构体中:①能发生水解反应;②能发生银镜反应;
的同分异构体中:①能发生水解反应;②能发生银镜反应;
③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式__________________。
(6)写出以C2H5OH为原料合成乳酸( )的路线(其它试剂任选)。(合成路线常用的表示方式为:A
)的路线(其它试剂任选)。(合成路线常用的表示方式为:A B……
B…… 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第五次周练化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,则下列判断正确的是
①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ ②有胶状物质生成
③有气体产生 ④溶液颜色发生变化 ⑤共发生了2个氧化还原反应。
A.仅①②③④ B.仅②③④ C.仅①③⑤ D.仅②④⑤
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三一模理综化学试卷(解析版) 题型:填空题
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为__________________。
(2)与CO互为等电子体的离子为__________(填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp杂化的分子有__________ 。
(4) C60用做比金属及其合金更为有效的新型吸氢材料,其分子结构中每一个C原子皆为SP2杂化,含多个σ键和π键,36gC60最多可以吸收标准状况下的氢气____________L。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是__________________ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如下图所示,则其中Ti4+的配位数为__________。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一下期末化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1L0.1 mol·L-1的氨水中含有0.1NA个OH-
B.78gNa2O2固体中含有的阴离子数目为2NA
C.常温下,23gNO2和N2O4的混合气体含有NA个氧原子
D.常温下,4gCH4中含有4NA个C—H共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com