
| 序号 | 实验操作 | 实验目的 |
| A | 测定HF、HCl熔点、沸点 | 比较F和Cl的非金属性强弱 |
| B | MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 | 比较镁、铝的金属性强弱 |
| C | 测定等浓度的H2CO3、H2SO3两溶液的pH | 比较碳、硫的非金属性强弱 |
| D | 向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量 | 比较氨水和氢氧化铝的碱性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.熔沸点属于物理性质,非金属性强弱属于化学性质;
B.复分解反应不能用以比较非金属性强弱;
C.比较非金属性应是最高价氧化物对应的水化物;
D.向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量,首先形成氢氧化铝白色沉淀,后沉淀的物质的量不变,后来沉淀溶解,变为澄清溶液.
解答 解:A.HF、HCl的熔点、沸点属于物理性质,非金属性强弱属于化学性质,不能用物理性质来比较化学性质,故A错误;
B.MgSO4、Al2(SO4)3溶液中分别滴加足量氨水都生成沉淀,属于复分解反应,不能用来比较非金属性强弱,故B错误;
C.H2SO3不是S元素最高价的含氧酸,所以不能通过测定等浓度的H2CO3、H2SO3两溶液的pH比较碳、硫的非金属性强弱,故C错误;
D.向氯化铵、氯化铝混合溶液中滴加氢氧化钠溶液至过量,首先形成氢氧化铝白色沉淀,后沉淀的物质的量不变,后来沉淀溶解,变为澄清溶液,可以比较氨水和氢氧化铝的碱性强弱,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及非金属性、金属性的实验设计,题目易错点为C,注意比较非金属性应是最高价氧化物对应的水化物,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
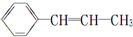 ,下列关于该烃的说法错误的是( )
,下列关于该烃的说法错误的是( )| A. | 该烃易溶于有机溶剂,但不易溶于水 | |
| B. | 1 mol该烃含有1 mol碳碳双键 | |
| C. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| D. | 能发生聚合反应,其产物可表示为: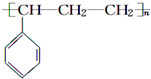 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
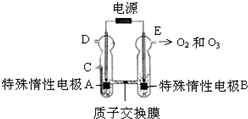 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ | 3,.0 | 4,.0 | 5,.0 | 6,.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定量的Ba(OH)2溶液中通入过量SO2气体SO2+OH-═HS${{O}_{3}}^{-}$ | |
| B. | 4 mol•L-1的NaAlO2溶液和7 mol•L-1的盐酸等体积混合4 Al${O}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 在碳酸氢钠溶液中加入等物质的量的氢氧化钙溶液Ca2++HC${O}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| D. | 用惰性电极电解氯化铝溶液2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
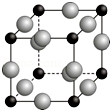 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢有三种同素异形体,分别是氕、氘、氚 | |
| B. | 氢有三种同位素,它们的相对原子质量分别是1、2、3 | |
| C. | 氢元素可形成三种互为通分异构体的物质:H2、D2、T2 | |
| D. | 氢元素的三种同位素原子可用一个原子结构示意图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
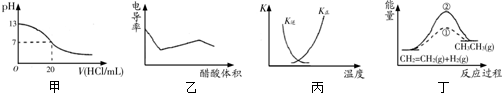
| A. | 甲表示25℃时用0.1 mol/L的盐酸滴定20 mL 0.1 mol/L KOH溶液,溶液的pH随加入盐酸体积的变化 | |
| B. | 乙表示醋酸溶液滴定NaOH和氨水混合溶液的电导率曲线 | |
| C. | 丙中曲线表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| D. | 丁中①、②曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com