
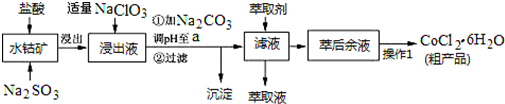
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
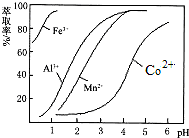
分析 含钴废料中加入盐酸、Na2SO3,加入盐酸和Na2SO3,可得CoCl2、AlCl3、FeCl2,加入NaClO3,发生氧化还原反应可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)酸性条件下,Co2O3和SO32-发生氧化还原反应生成Co2+、SO42-;
(2)酸性条件下,氯酸根离子能氧化亚铁离子生成铁离子,自身被还原生成氯离子;
酸性条件下ClO3-和Cl-发生氧化还原反应生成Cl2;
(3)“加Na2CO3调pH至a”,目的是除去铁离子、铝离子,所以需要将铁离子、铝离子转化为沉淀;
(4)CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴;
(5)由表中数据可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(6)根据CoCl2•6H2O的组成分析,可能是含有杂质,也可能是失去部分水.
解答 解:含钴废料中加入盐酸、Na2SO3,加入盐酸和Na2SO3,可得CoCl2、AlCl3、FeCl2,加入NaClO3,发生氧化还原反应可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)酸性条件下,Co2O3和SO32-发生氧化还原反应生成Co2+、SO42-,离子方程式为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)酸性条件下,氯酸根离子能氧化亚铁离子生成铁离子,自身被还原生成氯离子,离子方程式为ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
酸性条件下ClO3-和Cl-发生氧化还原反应生成Cl2,所以可能可能产生有毒气体氯气,离子方程式为ClO3-+5Cl-+6H+=3Cl2↑+3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)“加Na2CO3调pH至a”,目的是除去铁离子、铝离子,所以需要将铁离子、铝离子转化为沉淀,碳酸根离子和铝离子、铁离子发生双水解反应生成二氧化碳和氢氧化物沉淀,所以这两种沉淀的化学式为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(4)CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴,所以制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解,故答案为:降低烘干温度,防止产品分解;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液pH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(6)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水.
点评 本题通过制取CoCl2•6H2O的工艺流程考查了物质制备方案的设计,理解工艺流程图中可能发生的反应、实验操作与设计目的、相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA | |
| B. | 在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023 | |
| C. | 含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA | |
| D. | 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有6个电子 | B. | 位于元素周期表的第七周期 | ||
| C. | 主要化合价为-4价、+4价 | D. | “类铅”不能和盐酸反应放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Co2O3 | B. | Co3O3 | C. | Co3O4 | D. | Co5O7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若T1=T2,则x1>x2 | B. | 若T1=T2,则x1<x2 | C. | 若T1<T2,则x1=x2 | D. | 若T1<T2,则x1<x2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com