
【题目】已知反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是:( )
A.①中KCl 是氧化产物,KBr发生还原反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中氧化剂与还原剂的物质的量之比为1:6
D.③中1 mol氧化剂参加反应得到电子的物质的量为2.5 mol
【答案】B
【解析】
A. ①中Cl2是氧化剂,KCl 是还原产物,KBr是还原剂,发生氧化反应,A错误;
B. ①Cl2+2KBr=2KCl+Br2中氧化剂是Cl2,氧化产物是Br2,则氧化性:Cl2>Br2,②KClO3+6HCl=3Cl2+KCl+3H2O中氧化剂是KClO3,氧化产物是Cl2,则氧化性:KClO3>Cl2,③2KBrO3+Cl2=Br2+2KClO3中氧化剂是KBrO3,氧化产物是KClO3,所以氧化性:KBrO3>KClO3,故物质氧化性由强到弱顺序是KBrO3>KClO3>Cl2>Br2,B正确;
C. 在②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是KClO3,还原剂是HCl,参加反应的HCl中有![]() 作还原剂,所以氧化剂与还原剂的物质的量之比为1:
作还原剂,所以氧化剂与还原剂的物质的量之比为1:![]() ×6=1:5,C错误;
×6=1:5,C错误;
D. ③KBrO3是氧化剂,Br元素化合价由反应前+5价变为反应后Br2的0价,化合价降低5价,所以1 mol氧化剂参加反应得到电子的物质的量为5 mol,D错误;
故合理选项是B。


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】回答下列问题:
1L海水在逐渐浓缩过程中析出盐的种类和质量(单位:g)的关系如下表所示:
海水密度(gmL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
1.21 | 0.05 | 3.26 | 0.004 | 0.008 | — |
1.22 | 0.015 | 9.65 | 0.01 | 0.012 | — |
1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
1.31 | — | 1.40 | 0.54 | 0.03 | 0.06 |
注:画“—”的数据少于10-4,可以忽略不计。
(1)从海水中获得粗盐,一般采用的方法是___。
(2)根据上表,要获得杂质较少的食盐,应控制海水的最佳密度为___gmL-1(填字母)。
A.1.21 B.1.22 C.1.26 D.1.31
(3)粗盐中常含有MgCl2、MgSO4、CaCl2等杂质,要除去这些杂质,按顺序加入的试剂依次为NaOH、BaCl2、___、___等(填化学式)。
(4)工业上电解熔融氯化钠制取金属钠的化学方程式为___。
(5)钠元素的一种常见氧化物可作为呼吸面具的供氧剂,写出该氧化物和CO2反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物是药物生产的中间体,其结构简式如图。下列有关叙述正确的是( )
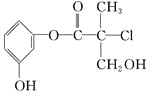
A. 该有机物能与溴水发生加成反应
B. 该有机物与浓硫酸混合加热可发生消去反应
C. 1 mol 该有机物与足量NaOH溶液反应最多消耗3 mol NaOH
D. 该有机物经催化氧化后能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为![]() ,下面有关PHB的说法不正确的是( )
,下面有关PHB的说法不正确的是( )
A.PHB通过加聚反应制得
B.PHB的单体是CH3CH2CH(OH)COOH
C.PHB在微生物作用下的降解产物可能有CO2和H2O
D.PHB是一种聚酯
查看答案和解析>>
科目:高中化学 来源: 题型:
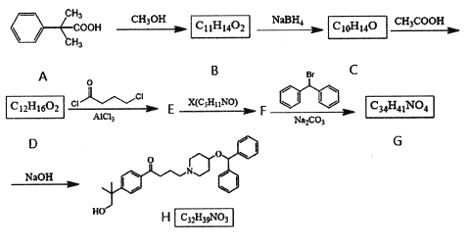
【题目】依巴斯汀是一种抗过敏药物,羟基依巴斯汀(H)是该药物在人体中的初级代谢产物,其人工合成路线如下:
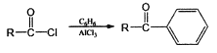
已知:
R-Cl![]() R-NH-R’
R-NH-R’
(1)F的结构简式为____________________
(2)下列说法不正确的是__________
A.l mol B可以和4 mol H2加成
B.X具有碱性
C.C可以发生取代、消去、加成等反应
D.1 mol E可以和3 mol NaOH反应
(3)写出由C生成D的反应方程式__________________________________________
(4)在F生成G过程中,Na2CO3的作用:___________________________________
(5)以苯和![]() 为原料合成
为原料合成![]() ,请设计出合成路径。___________
,请设计出合成路径。___________
(6)有机物Y的分子组成比X(C5H11NO)多1个“CH2”,写出三个满足下列条件的Y的同分异构体:________________________
①Y的分子中含有六元环状结构
②核磁共振氢谱表明Y分子中含有4种不同化学环境的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72— 还原为Cr3+。该反应的离子反应方程式为___________________________________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②“水浸”要获得浸出液的操作是______。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为____。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是____。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() +H2O)。
+H2O)。

①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为______。 ②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 __________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生可逆反应:H2(g)+I2(g)![]() 2HI(g)达到平衡状态时的标志是
2HI(g)达到平衡状态时的标志是
A.容器的压强恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ/mol)依次为 578、1 817、2 745、11 575、14 830、18 376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:_______。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是__________(用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是__________。
(4)写出Z元素的原子核外电子排布式_________。
(5)Q元素原子的未成对电子个数是________ 个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
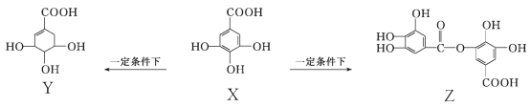
下列说法错误的是
A.1 mol Z最多能与7 mol NaOH发生反应
B.1 mol X最多能与2 mol Br2发生取代反应
C.Y分子结构中有3个手性碳原子
D.Y能发生加成、取代、消去、氧化、缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com