
短周期主族元素W、X、Y、Z 的原子序数依次增大,XW4分子电子总数为10,Z最外层电子数是次外层的3倍。下列说法不正确的是
A.W、X、Y、Z的原子半径大小顺序是X>Y>Z>W
B.元素Y的简单气态氢化物的热稳定性比X的强
C.含上述四种元素的化合物一定易溶于水
D.含上述四种元素的化合物可能既能与酸反应又能与碱反应
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法正确的是( )
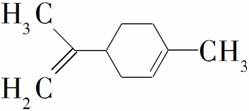
A.它的一氯代物有6种
B.它的分子中所有的碳原子一定在同一平面上
C.它和丁基苯(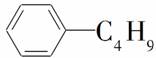 )互为同分异构体
)互为同分异构体
D.一定条件下,它可以发生加成、取代、氧化、还原等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:ClO-+Cl-+2H+=Cl2↑+H2O。下列说法正确的是( )
A.符合该离子方程式的化学方程式可以是:HClO+HCl= Cl2↑+H2O
B.标准状况下,每生成1.12L Cl2,转移0.05NA电子
C.在无色碱性溶液中,ClO-、Cl-、Al3+、Na+能大量共存
D.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好、更安全
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH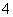 、Cl-、CO
、Cl-、CO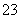 、SO
、SO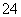 ,现分别取100 mL的两等份溶液进行如下实验:
,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)综合以上实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(2)写出②中产生沉淀的离子方程式 。
(3)某同学通过分析认为该溶液中K+一定 (填“存在”或“不存在”),他的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是
A.FeCl3溶液中加入过量的锌粉:Zn +2Fe3+=Zn2++2Fe2+
B.NH4Al(SO4)2中加入过量的NaOH溶液:Al3++4OH-=AlO2-+2H2O
C.(CH3COO)2Ba中加入稀硫酸:Ba2+ + SO42- = BaSO4↓
D.用惰性电极电解Cu(NO3)2溶液:2Cu2+ +2H2O  2Cu+ O2↑+ 4H+
2Cu+ O2↑+ 4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
氮氧化物与悬浮在大气中的海盐粒子相互反应:
4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol。下列叙述中正确的是
A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1
B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50%
C.若升高温度,平衡逆向移动,则该反应的△H >0
D.若起始时向容器中充入NO2(g) 0.2mol、NO(g) 0.1mol和Cl2(g) 0.1mol(固体物质足量),则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(一)乙酸正丁酯的制备
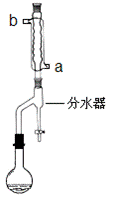
①在干燥的50mL圆底烧瓶中,加入13.5mL正丁醇和7.2mL冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应
(二)产品的精制
②将分水器分出的酯层和反应液一起倒入分液漏斗中,用10 mL的水洗涤。有机层继续用10 mL10%Na2CO3洗涤至中性,再用10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
③将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集125~127 ℃的馏分,得11.6 g乙酸正丁酯
请回答有关问题。
(1)冷水应该从冷凝管 ___________(填a或b)管口通入。
(2)步骤①中不断从分水器下部分出生成的水的目的是_________________________
步骤①中判断反应终点的依据是_____________________________________。
(3)产品的精制过程步骤②中,第一次水洗的目的是_____________________________,用饱和Na2CO3溶液洗涤有机层,该步操作的目的是_________________________________。
(4)下列关于分液漏斗的使用叙述正确的是____
A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
B.装液时,分液漏斗中液体的总体积不得超过其容积的2/3
C.萃取振荡操作应如右图所示
D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
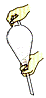
(5)步骤③的常压蒸馏,需收集126℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是_________________________
(6)该实验过程中,生成乙酸正丁酯(式量116)的产率是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A.向氯水中加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
27.Cl2氧化Br-应在 条件下进行,目的是为了避免
28.Br2可用热空气吹出,其原因是
29.写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为
30.为了除去工业Br2中微量的Cl2,可向工业Br2中
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com