
分析 (1)计算浓硫酸中H2SO4、H2O的质量,根据H2O的质量计算吸收SO3生成H2SO4质量,进而计算H2SO4总质量,再根据关系式H2SO4~H2SO4•SO3计算发烟硫酸质量;
(2)根据n=$\frac{m}{M}$计算H2SO4•SO3的物质的量,根据硫元素守恒计算n(H2SO4),再根据c=$\frac{n}{V}$计算;
(3)①根据硫元素守恒可得关系式:FeS2~2SO2~2SO3~2H2SO4,据此计算;
②根据硫元素守恒计算二氧化硫物质的量,设Fe3O4、Fe2O3物质的量分别为xmol、ymol,根据Fe原子守恒、O原子守恒列方程计算解答;
(4)98%的浓硫酸化学式可以表示为H2SO4.$\frac{1}{9}$H2O,假设硫化氢为amol,整个过程中SO2损失2%,则S元素利用率为98%,再根据S元素守恒表示出H2SO4.$\frac{1}{9}$H2O的物质的量,再根据H原子守恒计算硫化氢与水蒸气总物质的量,进而计算硫化氢的体积分数.
解答 解:(1)1kg 98%的浓硫酸中H2SO4的质量为1kg×98%=0.98g,故H2O的质量为1kg-0.98g=0.02kg,由H2O+SO3=H2SO4,可知生成H2SO4的质量为0.02kg×$\frac{98}{18}$,故H2SO4总质量=0.98g+0.02kg×$\frac{98}{18}$=$\frac{9.8}{9}$kg,根据关系式H2SO4~H2SO4•SO3,可知得到发烟硫酸质量为:$\frac{9.8}{9}$kg×$\frac{98+80}{98}$=1.978kg,
故答案为:1.978;
(2)H2SO4•SO3的物质的量为$\frac{890g}{178g/mol}$=5mol,根据硫元素守恒n(H2SO4)=2n(H2SO4•SO3)=10mol,该硫酸的物质的量浓度为$\frac{10mol}{4L}$=2.5mol/L,
故答案为:2.5;
(3)①设理论上可生产x吨98%的浓硫酸,则:
FeS2~2SO2~2SO3~2H2SO4
120 2×98
1吨×80% x吨×98%
所以120:2×98=1吨×80%:x吨×98%,解得x=1.33
答:理论上可生产1.33吨98%的浓硫酸;
②根据硫元素守恒,n(SO2)=2n(FeS2)=48mol,消耗氧气物质的量为65.5mol,设Fe3O4、Fe2O3物质的量分别为xmol、ymol,根据Fe原子守恒、O原子守恒,则:$\left\{\begin{array}{l}{3x+2y=24}\\{4x+3y=65.5×2-48×2}\end{array}\right.$,解得:$\left\{\begin{array}{l}{x=2}\\{y=9}\end{array}\right.$,故Fe3O4、Fe2O3物质的量之比为2:9,
答:反应产物中Fe3O4与Fe2O3物质的量之比为2:9;
(4)98%的浓硫酸中H2SO4、H2O的物质的量之比为$\frac{98g}{98g/mol}$:$\frac{2g}{18g/mol}$=1:$\frac{1}{9}$,98%的浓硫酸化学式可以表示为H2SO4.$\frac{1}{9}$H2O,假设硫化氢为amol,整个过程中SO2损失2%,则S元素利用率为98%,根据S元素守恒,H2SO4.$\frac{1}{9}$H2O的物质的量amol×98%,根据H原子守恒,硫化氢与水蒸气总物质的量为amol×98%×(1+$\frac{1}{9}$)=$\frac{9.8a}{9}$mol,故硫化氢的体积分数为$\frac{amol}{\frac{9.8a}{9}mol}$=0.918,
答:硫化氢在混合气中的体积分数为0.918.
点评 本题考查化学计算,涉及混合物的有关计算、根据方程式的有关计算,过程复杂、计算量很大,为易错题目,难度较大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:6:9 | B. | 1:2:3 | C. | 1:3:3 | D. | 1:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
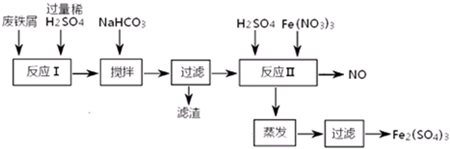
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com