
| A. | 1.0mol | B. | 1.6mol | C. | 2.2mol | D. | 2.4mol |
分析 n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,由生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量,由气体的物质的量可得被还原的硝酸的物质的量,以此计算反应消耗的硝酸的物质的量.
解答 解:n(气体)=$\frac{22.4L}{22.4L/mol}$=1mol,被还原的硝酸的物质的量为1mol;
n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,则生成n(Cu(NO3)2)=0.6mol,可知表现酸性的硝酸的物质的量为0.6mol×2=1.2mol,
可知参加反应的硝酸的物质的量为:1mol+1.2mol=2.2mol,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、反应产物及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的为最大 | |
| B. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| C. | 同主族两种元素原子的核外电子数的差值可能为26 | |
| D. | 科学家在周期表中金属元素与非金属元素分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOC2H5+H2O$\stackrel{{H}^{+}}{→}$CH3COOH+C2H5OH | |
| B. | CH2═CH2+H2$\stackrel{催化剂}{→}$CH3CH3 | |
| C. | 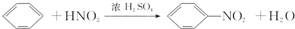 | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IVA族 | B. | 第三周期 IV A族 | C. | 第三周期 VI A族 | D. | 第二周期VI A族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:乙烷>戊烷>2-甲基丁烷 | B. | 同分异构体种类:戊烷<戊烯 | ||
| C. | 密度:苯<水<硝基苯 | D. | 点燃时火焰明亮程度:乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙烯时浓硫酸是催化剂和吸水剂 | |
| B. | 硝基苯制备时浓硫酸作催化剂和脱水剂 | |
| C. | 实验室制备乙烯、硝基苯、苯磺酸时均使用到温度计,且水银球在反应混合物液面以下 | |
| D. | 水浴加热的优点是可以受热均匀且便于控制温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com