
��ѧ����ᡢ���������������أ�����˵����ȷ����
��ʯӢֻ�������������ά���ҳ����²���ǿ�ᷴӦ��
�ڴ���������Һ�����ڻ���������ɱ����
�ۺڻ�ҩ����ơ���ʯ��ľ̿�������ʰ�һ����������Ƴɣ�
����ͭƬ�ڼ��ȵ������¾Ϳɼ���Ũ�����ϡ���
��70mL��H2S��90mL��O2��ϵ�ȼ��ָ���ԭ״���ɲ���70mL��SO2��
������CO2����ͨ��ˮ�����п����ɹ���ʹ���
A���٢ڢܢ� B���٢ڢۢ� C���ڢܢ� D���ڢۢ�
D
��������
�����������ʯӢ������������ᷴӦ�� �ٴ��ڴ���������Һ����ǿ�����ԣ������ڻ���������ɱ��������ȷ���ۺڻ�ҩ����ơ���ʯ��ľ̿�������ʰ�һ����������Ƴɣ�����ȷ����ͭƬ�ڼ��ȵ���������Ũ���ᷴӦ��ϡ�����Ӧ��������ͭƬ�ڼ��������¿ɼ���Ũ�����ϡ���ᣬ����ȷ����70mL��H2S��90mL��O2��ϵ�ȼ��ָ���ԭ״���ɲ���55mL��SO2 ���ݴ�������CO2����ͨ��ˮ�����п����ɹ����С�մ���ѡD��
���㣺STS֪ʶ


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡʦ��һ����һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ֻ�ܱ�ʾһ����ѧ��Ӧ�����ӷ���ʽ����
A��Cu(OH)2+2HCl=CuCl2+2H2O Cu(OH)2+2H+=Cu2++2H2O
B��FeSO4+Ba(OH)2=Fe(OH)2��+BaSO4�� Fe2++SO42��+Ba2++2OH��=Fe(OH)2��+BaSO4��
C��Ba(OH)2+H2SO4=BaSO4��+2H2O Ba2++2OH��+2H++SO42��=BaSO4��+2H2O
D��2HCl+Fe(OH)2=Fe2++2H2O 2H+ + Fe(OH)2=Fe2++ 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��ˮ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Һ�п��ܺ���H����Na����NH4+��Mg2����Fe3����Al3����SO42����CO32�������ӡ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ����ͼ��ʾ������˵����ȷ����

A��ԭ��Һ�к��е���������H����NH4+��Mg2����Al3��
B��ԭ��Һ�к��е�Fe3����Al3�������ʵ���֮��Ϊ1��1
C��ԭ��Һ��һ������SO42����Na��
D����Ӧ����γɵ���Һ������ֻ��Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ�ڵ��Ĵ��¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
��ѡ��������ѧ����ѡ��5���л���ѧ��������15�֣�������H��������·�ߺϳɣ�

��֪��
�ش��������⣺
��1��11.2L����״��������A�������г��ȼ�տ�������88gCO2��45gH2O����A���ӽṹ����3��������A�Ľṹ��ʽΪ ��
��2��B��C��Ϊһ�ȴ�����D�����ƣ�ϵͳ������Ϊ ��
��3���ڴ���������1molF��2molH2��Ӧ������3��������1��������F�Ľṹ��ʽ__
��4����Ӧ�ٵķ�Ӧ������ ��
��5����Ӧ�ڵĻ�ѧ����ʽΪ ��
��6��д��������G������ͬ�����ŵķ�����ͬ���칹��Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ�ڵ��Ĵ��¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͼ��ʾ�١�������װ�õ�������ȷ����
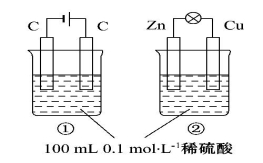
ѡ�� | �� �� | ���� |
A | װ������:�ٵ���,��ԭ��� | ���� |
B | ����Ũ�ȱ仯:������,�ڼ�С | ���� |
C | �缫��Ӧʽ ������:Zn-2e-====Zn2+ :������:4OH--4e-====2H2O+O2�� | ��ȷ |
D | �����ƶ�����:��H+�������ƶ� ��H+�������ƶ� | ��ȷ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ����������ĵ��볣�����£�
����Ļ�ѧʽ | CH3COOH | HCN | H2S |
���볣����25�棩 | 1.8��10-5 | 4.9��10-10 | K1��1.3��10-7 K2��7.1��10-15 |
25��ʱ������˵����ȷ����
A�������ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B��a mol/LHCN��Һ��b mol/LNaOH��Һ�������ϣ�������Һ��c(Na+)>c(CN-)����aһ��С�ڻ����b
C��NaHS��Na2S�Ļ����Һ�У�һ������c(Na+)��c(H+)��c(OH-)��c(HS-)��2c(S2-)
D��ijŨ�ȵ�NaCN��Һ��pH��d����������ˮ�������c(OH-)��10-dmol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���н�����ʵ�����ӷ���ʽ��ȷ����
A������ϡ���ᷴӦ�Ƶ�dz��ɫ��Һ��Fe + 4H+ + NO3�� ��Fe3+ + NO��+ 2H2O
B����Ca(ClO)2��Һ��ͨ�����CO2��ȡ�����2ClO��+ H2O + CO2 ��2HClO + CO32��
C��������KMnO4��Һ��ͨ��SO2��2MnO4��+ 5SO2 + 4OH����2Mn2++ 5SO42��+ 2H2O
D��0.01 mol��L��1 NH4Al(SO4)2��Һ��0.02 mol��L��1 Ba(OH)2��Һ�������ϣ�NH4++ Al3++ 2SO42-+ 2Ba2++ 4OH��=2BaSO4��+ Al(OH)3��+ NH3��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ������ѧ��12��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ϊ2 L�ĺ����ܱ������з�����ӦxA(g)+yB(g) zC(g)��ͼI��ʾ200��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A):n(B)�ı仯��ϵ�������н�����ȷ����
zC(g)��ͼI��ʾ200��ʱ������A��B��C���ʵ�����ʱ��ı仯��ͼ���ʾ��ͬ�¶���ƽ��ʱC�������������ʼn(A):n(B)�ı仯��ϵ�������н�����ȷ����

A��200��ʱ����Ӧ�ӿ�ʼ��ƽ���ƽ������v(B)= 0. 02 mol��L��1��min��1
B��ͼ����֪��ӦxA(g)+yB(g) zC(g)�ġ�H<0����a=2
zC(g)�ġ�H<0����a=2
C������ͼ����ʾ��ƽ��״̬�£�������ϵ�г���0.2molB��0.2molC�����´ﵽƽ��ǰv(��)>v(��)
D����200��ʱ���������г���2 mol A ��1 mol B���ﵽƽ��ʱ��A �������������0.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��ˮ�и���һ�ָ�ϰ����֪ʶ��⻯ѧ�Ծ��������棩 ���ͣ������
��16�֣�����̼ѭ������������ĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӡ����ԡ���̼���á�����Ϊ��ѧ���о�����Ҫ���⡣
��1���õ绡���ϳɵĴ�������̼�ܳ����д�����̼�����������ʣ������ֿ������������������ᴿ������ɸ÷�Ӧ�Ļ�ѧ����ʽ�����ڷ���������ϵ����
��C+��KMnO4+��H2SO4 ����CO2��+��MnSO4 +��K2SO4+��
��2������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g) CO2(g)��H2(g)���õ����¶������ݣ�
CO2(g)��H2(g)���õ����¶������ݣ�
ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
��ʵ��1�����£���Ӧ�ӿ�ʼ���ﵽƽ�⣬��v(CO2)��ʾ�ķ�Ӧ����Ϊ ������С������λ������ͬ����
��ʵ��2������ƽ�ⳣ��K= ���÷�ӦΪ ������ȡ����ȡ�����Ӧ��
��3����֪�ڳ��³�ѹ�£�
��2CH3OH(l) +3O2(g)��2CO2(g)+4H2O(g) ��H1 ����1275.6 kJ/mol
��2CO (g)+ O2(g)��2CO2(g) ��H2 ����566.0 kJ/mol
��H2O(g)��H2O(l) ��H3 ����44.0 kJ/mol
д���״�����ȫȼ������һ����̼����̬ˮ���Ȼ�ѧ����ʽ�� ��
��4��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�á�

�õ�������ĵ缫��ӦʽΪ ���õ�ع���ʱ����Һ�е�OH���� ����������������ƶ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com