
1. M(NO3)2热分解化学方程式为:2 M(NO3)2  2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
2MO+4NO2↑+O2↑。加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
A.64g/mol B.24g/mol C.65g/mol D.40g/mol
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
|
| 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:
(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。
反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013年安徽舒城晓天中学高三上学期实验班半月考化学试卷(带解析) 题型:实验题
(13分)某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A、比mg多 B、比mg少 C、恰好为mg
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器是 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ②Fe2(SO4)3 ③Mg(NO3)2
查看答案和解析>>
科目:高中化学 来源:(教师解析专用)2009~2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
| | 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
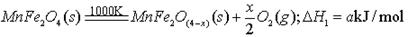
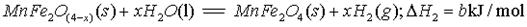
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用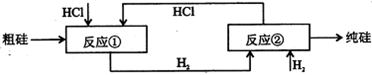
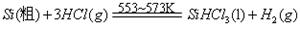
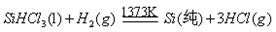
查看答案和解析>>
科目:高中化学 来源:2013届安徽舒城晓天中学高三上学期实验班半月考化学试卷(解析版) 题型:实验题
(13分)某种含有少量FeCl2杂质的FeCl3样品,现要测定其中铁元素的含量。实验采用以下步骤进行:
①准确称量m g样品(2~3g);
②向样品中加入10mL 5mol/L的盐酸,再加入蒸馏水,配制成250mL溶液;
③量取25mL操作②中配得的溶液,加入3mL溴水,加热使之完全反应;
④趁热迅速加入浓度为10%的氨水至过量,充分搅拌,使之完全沉淀;
⑤过滤,将沉淀洗涤、灼烧、冷却称量,反复操作至恒重。
请根据上面的叙述回答:
(1)若称量前,托盘天平的指针偏向标尺左方;称量读数时,指针刚好在标尺的中间,则所得样品的质量 。
A、比mg多 B、比mg少 C、恰好为mg
(2)溶解样品时要加入盐酸,原因是 。
(3)配制250mL溶液时,除需250mL的容量瓶、烧杯外,还需用到的玻璃仪器是 。
(4)加入溴水时发生反应的离子方程式是 。
(5)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量是W2 g,则样品中铁元素的质量分数是 。
(6)若在配制250mL溶液时,所用的容量瓶没有洗干净。当含有下列物质时,最终会使铁元素的测定含量(填“偏高”、“偏低”或“不变”)。
①NaCl ②Fe2(SO4)3 ③Mg(NO3)2
查看答案和解析>>
科目:高中化学 来源:2009-2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH如右表所示。
|
|
开始沉淀 |
完全沉淀 |
|
Fe3+ |
2.7 |
4.2 |
|
Mn2+ |
8.3 |
10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:


(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。

反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com