
| A. | Cu | B. | Fe | C. | Al | D. | Mg |
科目:高中化学 来源: 题型:解答题
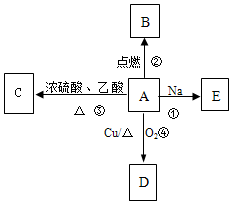 A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:
A是易溶于水的有机物C2H5OH,能发生如图所示的多种反应(部分产物已略),D的相对分子质量为44,分子式为C2H4O.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J | K |
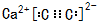 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | △H/(kJ?mol-1) | 化学式 | △H/(kJ?mol-1) |
| CO(g) | -283.0 | CH4(g) | -890.3 |
| H2(g) | -285.8 | CH3OH(l) | -726.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定伴随物质的状态变化 | |
| D. | 化学变化一定有新物质生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
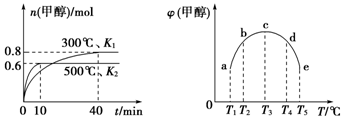
| A. | 该反应的△H1>0,且K1>K2 | |
| B. | 将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有升温或加压 | |
| C. | 300℃时,向平衡后的容器中再充入0.8 mol CO,0.6 mol H2,0.2 mol CH3OH,平衡正向移动 | |
| D. | 500℃时,向平衡后的容器中再充入1 mol CH3OH,重新平衡后,H2浓度和百分含量均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com