
| A. | 新制氯水久置后酸性增强 | |
| B. | 因为氯气有毒,有强氧化性,所以可用于杀菌,消毒,漂白 | |
| C. | 除去氯气中少量氯化氢可使气体通过饱和食盐水 | |
| D. | 新制备的氯水可使蓝色石蕊试液先变红后褪色 |
分析 A、新制的氯水久置时发生HClO分解生成HCl和O2的反应;
C、因为氯气具有强氧化性,可用于杀菌,消毒,漂白,与氯气有毒无关;
C、HCl可被饱和食盐水吸收,而氯气在饱和食盐水中的溶解度很小;
D、新制的氯水显酸性和漂白性.
解答 解:A、新制的氯水久置时发生HClO分解生成HCl和O2的反应,溶液酸性增强,故正确;
B、因为氯气具有强氧化性,可用于杀菌,消毒,漂白,与氯气有毒无关,故B错误;
C、HCl可被饱和食盐水吸收,而氯气在饱和食盐水中的溶解度很小,所以除去氯气中少量氯化氢可使气体通过饱和食盐水,故C正确;
D、新制的氯水显酸性和漂白性,所以新制备的氯水可使蓝色石蕊试液先变红后褪色,故D正确;
故选B.
点评 本题需要注意的是氯气无漂白性,遇到水生成次氯酸,次氯酸具有漂白性.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
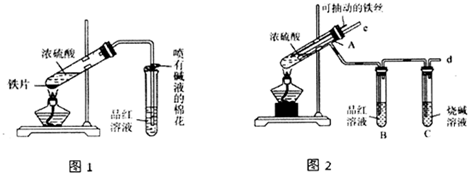
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水和稀硝酸的反应 | B. | Mg(OH)2和稀H2SO4的反应 | ||
| C. | NaOH溶液和碳酸的反应 | D. | 氢气和氧气的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠 | B. | 碳酸钠,硅酸钠 | C. | 碳酸钠,二氧化硅 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
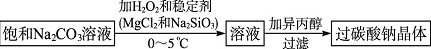
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 已知Ka(HClO)>Ka2(H2CO3),则有:2ClO-+CO2(少量)+H2O═CO32-+2HClO | |
| C. | 金溶于王水生成AuCl4-离子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | NO2 | 硫酸亚铁 | H2O | 溶液颜色变黄 |
| B | CO2 | 氯化钡溶液 | Ca(OH)2 | 白色沉淀 |
| C | SO2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | NH3 | AgNO3 | H2SO4 | 先有白色沉淀后溶解 |

| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com