
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
工业上一般以CO和H2为原料合成甲醇,该反应的热化 学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mo
CH3OH ( g ) △H=-116kJ/mo
(1) 该反应的化学平衡常数表达式为 ;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是:
(填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3 ) 一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c ( H2 )/ c (CH3OH )减小
(4)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生
成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
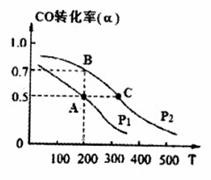 ① A、C两点都表示达到的平衡状
① A、C两点都表示达到的平衡状
态,则自反应开始到达平衡状态所需的时间,tA tC(填“大于”、“小于’’或“等于")。
② 若A点时容器的体积为1 L,则该温度下B点的平衡常数 K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

⑴ 该合成路线对于环境保护的价值在于 ▲ 。
⑵ 15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因: ▲ 。
 ⑶ CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: ▲ 。
⑶ CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: ▲ 。
⑷ 科学家发明了一种基于右图所示原理的廉价光电化学电池装置,
写出光照时半导体电极表面发生的电极反应式 ▲ 。目前应用最
多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可
作为新能源的原因可能的是 ▲ 。
a.在自然界中存在大量的单质硅
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全运输、贮存
查看答案和解析>>
科目:高中化学 来源: 题型:
不能证明下列物质具有漂白性的是( )
A.品红溶液通入SO2后,红色消失
B.显红色的酚酞溶液通入SO2后,红色褪去
C.加有酚酞的水中投入Na2O2粉末溶液先变红,后褪色
D.将新制氯水滴入紫色石蕊试液先变红,后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质; F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸; C和D是两种常见的强酸。请回答下列问题:

(1)写出物质B和M的化学式:B. ,M ;
(2)写出反应②的离子方程式: ;
(3)写出反应⑥的化学方程式: ;
(4)在反应①②③④⑤⑥中,属于氧化还原反应的有: 。(填编号)
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4是一种重要的化石燃料,在工农业生产中有着极其重要的应用。
(1)用甲烷可以消除氮氧化物的污染,其反应如下:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(1)130℃时,达到平衡状态时CH4的转化率为 。当温度为180℃、反应到40 min时,该反应 (填“是”或“否”)达到平衡,推断的依据是 。
(2)由表中数据分析可知,该反应的ΔH 0(填“=”、“﹥”或“﹤”),130℃和180℃平衡常数的关系:K(130℃) K(180℃)(填“=”、“﹥”或“﹤”)。
 (3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a电极上发生反应的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填“增大”、“减小”或“不变”)。
③若完全反应后,装置Ⅱ中Cu极质量减少12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(4)用甲烷制取氢气的反应分为两步,其能量变化如下图所示:
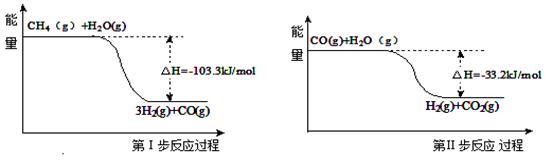
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实不能证明醋酸是弱酸的是
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是
A.可以利用丁达尔效应区分胶体和溶液 B.胶体中分散质直径大于100 nm
C.根据分散质微粒直径大小,可将分散系分为溶液、胶体和浊液
D.向沸水中逐滴加入几滴饱和FeCl3溶液,煮沸至呈红褐色,制得Fe(OH)3胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com