
下列有关表述不正确的是
A.—OH与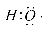 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
B.丙烷的分子结构模型示意图: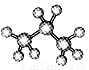
C.次氯酸的电子式为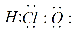
D.熔化时NaHSO4的电离方程式为NaHSO4===Na++HSO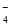
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:2015届浙江省温州市十校联合体高三上学期期中联考化学试卷(解析版) 题型:填空题
(本题共14分)A、B、D、E、F为短周期元素,元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)D在周期表中的位置是 ,A与B组成的一种化合物中A的质量分数为25%,则该化合物的空间构型 ,A2D的沸点高于BD2的原因 ;
(2)比较B、D、E的原子半径 (用元素符号表示);
(3)上述五种元素间可形成多种化合物,写出含有元素A的二元离子化合物与A2D反应的化学方程式 ;
(4)写出一种工业制备单质F的离子方程式 ;
(5)由D与E组成的既含离子键又含共价键的化合物与BD2反应的化学方程式 ;
(6)B、E、 D组成一种水溶液呈碱性的盐,其原子个数之比为1 :2 :3 ,请设计一个简单的实验检验该盐的化学成份。 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三9月月考化学试卷(解析版) 题型:选择题
下列实验设计及其对应离子方程式均正确的是( )
A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+
B.Na2O2与H2O反应制备O2:Na2O2+H2O===2Na++2OH-+O2↑
C.将氯气溶于水制备次氯酸:Cl2+H2O===2H++Cl-+ClO-
D.用浓盐酸酸化的KMnO4与H2O2反应,证明H2O2具有还原性:2MnO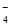 +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi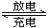 LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
A.锂在放电时做正极材料,充电时为阳极材料
B.电池在放电时,Li+向负极移动
C.该电池充电时阳极的反应为:LixV2O5 -xe-=V2O5 + xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三月考(10月)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.π键是由两个p轨道“头碰头”重叠形成的
B.σ键就是单键,π键就是双键
C.乙烷分子中的键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中含σ键,而Cl2分子中含π键
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:填空题
(9分)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
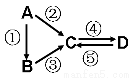
(1)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。写出其中D与水反应生成的酸名称 。
(2)若B是气态氢化物。C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式 。
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
下列各组中的离子能在溶液中大量共存,向溶液中加入NaOH溶液时产生沉淀,且加入盐酸时放出气体的离子组是
A.OH-、Ba2+、NO3-、K+ B.Fe2+、Ca2+、Br-、NO3-
C.Na+、SO42-、Cu2+、Cl- D.CO32-、Cl-、Na+、Ba2+
查看答案和解析>>
科目:高中化学 来源:2015届浙江省杭州市高三10月月考化学试卷(解析版) 题型:选择题
下列氧化还原反应中,水作为氧化剂的是
A.CO+H2O(g)  CO2+H2 B.3NO2+H2O===2HNO3+NO
CO2+H2 B.3NO2+H2O===2HNO3+NO
C.2Na2O2+2H2O===4NaOH+O2↑ D.2F2+2H2O===4HF+O2
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:填空题
(8分)污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
⑴为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
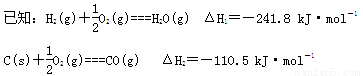
写出焦炭与水蒸气反应的热化学方程式______________________。
该反应的平衡常数表达式为K=_________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是________(选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
⑵为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq),ΔH3
为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则:
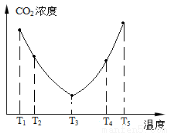
①ΔH3____0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的可能原因有:___________________________;__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com