
结构简式 为含一个三键的炔烃氢化后的产物,则此炔烃可能有的结构有( )
为含一个三键的炔烃氢化后的产物,则此炔烃可能有的结构有( )
A.1种 B.2种
C.3种 D.4种
科目:高中化学 来源: 题型:
用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.1 mol OH- 中含有9NA个电子
B. 28 g CO气体中含有NA个氧原子
C.1 L 1 mol/L AlCl3溶液中含有NA个Al3+
D.常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于材料的说法不正确的是( )
A.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
B.二氧化硅可用作光导纤维
C.石英玻璃耐强酸强碱,可用来制造化学仪器
D.Si3N4是一种新型无机非金属材料,可用于制造发动机
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z为单质,其他为化合物。其中Y为气体,G溶液呈黄色,E是不溶于水的酸性氧化物,能与氢氟酸反应,它们之间存在如图K133所示的转化关系(部分产物已略去)。
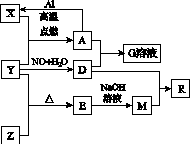
图K133
请回答下列问题:
(1)写出物质E的一种用途:________________________________________________________________________。
(2)写出A和D的稀溶液反应生成G的离子方程式:
__________________________________________。
(3)向含4 mol D的稀溶液中,逐渐加入X粉末至一定量。假设D完全反应且生成的气体只有一种,则反应的X的物质的量范围为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
mmol C2H2跟nmol H2在密闭容器内反应,当达到平衡时,生成pmol C2H4。将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
A.(3m+n)mol B.(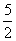 +
+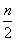 -3p)mol
-3p)mol
C.(3m+n+2p)mol D.(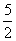 m+
m+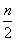 )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究乙炔与溴的加成反应,甲同学设计并进行了如下的实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色的浑浊,推测在制得的乙炔中还可能含有少量的杂质气体,由此他提出必须除去之,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中两个主要反应的化学方程式____________;________________________________________________________。
(2)甲同学设计的实验(填“能”或“不能”)验证乙炔与溴水发生加成反应,其理由是。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙炔
D.使溴水褪色的物质,就是乙炔
(3)乙同学推测在制得的乙炔中含有的杂质气体是,它与溴水反应的化学方程式为____________________________________,在验证过程中必须全部除去。
(4)请你选用下图所列的四个装置(可重复使用)试验乙同学的实验方案,将它们的编号填入方框,并在括号中写出装置内所放的化学药品。
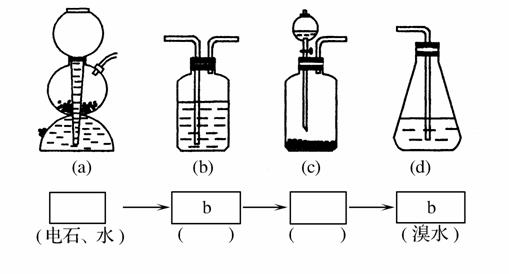
(5)为验证这一反应是加成反应而不是取代反应,丙同学提出可用pH试纸来测试反应后的溶液的酸性,理由是_____________________
______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。

(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向2.0 L恒容密闭容器中充入1.0 mol PCl5,在温度为T时发生反应PCl5(g) 
 PCl3(g)+Cl2(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g) ΔH=+124 kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
回答下列问题:
(1)反应在前50 s的平均速率v(PCl5)=____________。
(2)温度为T时,该反应的化学平衡常数=________。
(3)要提高上述反应的转化率,可采取的措施有______________。
(4)在温度为T时,若起始时向容器中充入0.5 mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=________。
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是________________________________________________________________________。
若将0.01 mol PCl5投入1 L热水中,再逐滴加入AgNO3溶液,先产生的沉淀是________[已知Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10]。
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,生成该气体与消耗的白磷的物质的量之比为20∶3,反应的化学方程式为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com