
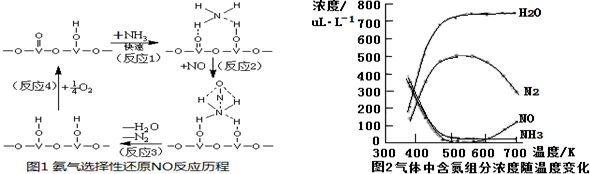

分析 (1)依据盖斯定律计算反应热,写出反应的热化学方程式;
(2)令CO的浓度变化为c,用三段式表示出各物质变化的浓度、平衡时的浓度,再根据平衡常数计算;
(3)①用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式;
②由该反应的平衡常数与温度的关系lg Kp=5.08+217.5/T,平衡常数是温度的减函数,即升高温度,化学反应逆向移动,所以该反应是放热反应;
③由图2分析,当温度达到700K时,与500K-600K比较,相同氨气形成相同水的时,生成的N2在减少,NO在增加,说明氨催化氧化生成了NO,故此时的副反应产物是NO.
(4)①食盐水做电解液电解烟气(Cl2)脱氮,根据氧化还原反应的规律可得反应;
②次氯酸钠在酸性条件下氧化性增强,故溶液的pH对NO去除率会有影响;
③根据电荷量(Q)=电流密度×极板面积×时间=n(e-)?F,可知NO除去率.
解答 解:(1)依据盖斯定律将CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1与CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1两方程式相加后再除以2,得2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,故答案为:2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1;
(2)对于反应 CO(g)+H2O(g)  H2(g)+CO2(g),
H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以$\frac{c×c}{(0.02-c)×(0.02-c)}$=9,解得c=0.015
所以CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%.
故答案为:75%.
(3)①用V2O5作催化剂,NH3可将NO还原成N2,结合反应历程图可知反应物还有氧气,生成物为N2和H2O,配平即得反应方程式为4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O,故答案为:4NH3+4NO+O2$\frac{\underline{\;V_{2}O_{5}\;}}{\;}$4N2+6H2O;
②平衡常数是温度的减函数,则该反应是为放热反应,故答案为:放热;
③由图2分析,当温度达到700K时,生成的N2在减少,NO在增加,说明氨催化氧化生成了NO,故此时的副反应是:4NH3+5O2 4$\frac{\underline{催化剂}}{△}$NO+6H2O,故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)①氯气作氧化剂,NO为还原剂,在碱性条件下的反应为:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O,故答案为:3Cl2+8OH-+2NO=2NO3-+6Cl-+4H2O;
②次氯酸钠在酸性条件下氧化性增强,故溶液的pH对NO去除率会有影响,故答案为:次氯酸钠在酸性条件下氧化性增强;
③根据电荷量(Q)=电流密度×极板面积×时间=n(e-)?F,NO除去率:$\frac{\frac{1.0A.c{m}^{-2}×1s×10c{m}^{2}}{96500c.mo{l}^{-1}×3}}{\frac{0.070L.{s}^{-1}×15%}{22.4L.mo{l}^{-1}}}$×100%=73.7%,故答案为:$\frac{\frac{1.0A.c{m}^{-2}×1s×10c{m}^{2}}{96500c.mo{l}^{-1}×3}}{\frac{0.070L.{s}^{-1}×15%}{22.4L.mo{l}^{-1}}}$×100%=73.7%.
点评 本题考查了盖斯定律求反应热、化学平衡常数及化学平衡移动的影响因素、氧化还原反应等,题目难度中等.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
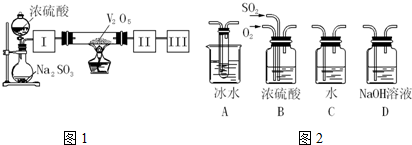
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| B. | 当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率 | |
| C. | 单位时间内生成CO和Cl2的物质的量比为1:1时,反应达到平衡状态 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变加入H2 | B. | 压缩体积至原来的一半 | ||
| C. | 降低温度 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
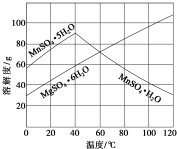 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2═MnSO4.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com