
实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)2SO3(g) ΔH=-196.64 kJ·mol-1,当放出314.624 kJ热量时,SO2的转化率为________。
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表数据判断,错误的是 ( )
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 800 | 2 700 | 11 600 |
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的ΔH=100 kJ·mol-1,下列有关该反应的叙述正确的是( )
A.正反应活化能小于100 kJ·mol-1
B.逆反应活化能一定小于100 kJ·mol-1
C.正反应活化能不小于100 kJ·mol-1
D.正反应活化能比逆反应活化能小100 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=890.3 kJ·mol-1
②CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ·mol-1
A.仅有② B.仅有②④ C.仅有②③④ D.全部符合要求
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2NO2(g)N2O4(g) ΔH1
2NO2(g)N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
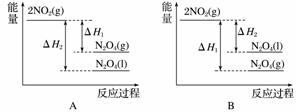
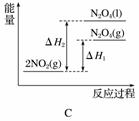
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com