
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
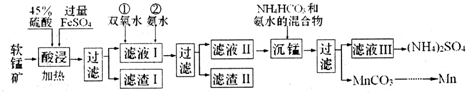
分析 I.软锰矿用硫酸、硫酸亚铁溶解,二氧化硅不反应,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,滤液I中加入过氧化氢,将Fe2+氧化为Fe3+,通入氨气调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再过滤分离,滤液Ⅱ中加入碳酸氢铵与氨水的混合物得到碳酸锰,再过滤分离.
(1)“酸浸”中MnO2在酸性条件下被Fe2+还原为Mn2+,Fe2+被氧化生成Fe3+;
(2)滴加双氧水将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;
结合Ksp[Mn(OH)2]=c(Mn2+)×c2(OH-)=10-13计算c(OH-),进而计算控制溶液pH;
(3)Mn2+与HCO3-、NH3•H2O反应生成MnCO3、NH4+与H2O;
(4)碳酸锰分解生成Mn2O3,Al与Mn2O3发生置换反应得到Mn;
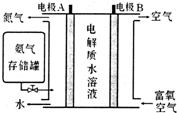
Ⅱ.(5)负极发生氧化反应,由图可知,碱性条件下氨气失去电子生成氮气与水;
(6)计算转移电子物质的量,再根据电子转移守恒计算高锰酸钾的物质的量,进而计算其质量.
解答 解:I.软锰矿用硫酸、硫酸亚铁溶解,二氧化硅不反应,由沉锰后得到碳酸锰,可知酸性条件下二氧化锰被亚铁离子还原为Mn2+,过滤分离,滤液I中加入过氧化氢,将Fe2+氧化为Fe3+,通入氨气调节溶液pH,将Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去,再过滤分离,滤液Ⅱ中加入碳酸氢铵与氨水的混合物得到碳酸锰,再过滤分离.
(1)“酸浸”中MnO2在酸性条件下被Fe2+还原为Mn2+,Fe2+被氧化生成Fe3+,反应离子方程式为:MnO2+2Fe2++4H+$\frac{\underline{\;加热\;}}{\;}$Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+$\frac{\underline{\;加热\;}}{\;}$Mn2++2Fe3++2H2O;
(2)滴加双氧水将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去,
滤液I 中c(Mn2+)=0.1mol•L-1,结合Ksp[Mn(OH)2]=c(Mn2+)×c2(OH-)=10-13,可知c(OH-)=$\sqrt{\frac{1{0}^{-13}}{0.1}}$mol/L=10-6mol/L,则溶液中c(H+)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=10-8mol/L,此时溶液pH=-lg10-8=8,
故答案为:将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;8;
(3)Mn2+与HCO3-、NH3•H2O反应生成MnCO3、NH4+与H2O,反应离子方程式为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O;
(4)碳酸锰分解生成Mn2O3,Al与Mn2O3发生置换反应得到Mn,制备过程中最后一步反应的化学方程式:Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn,
故答案为:Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn;
Ⅱ.(5)负极发生氧化反应,由图可知,碱性条件下氨气失去电子生成氮气与水,负极电极反应式为:2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
(6)转移电子物质的量为$\frac{600s×0.5A}{96500C/mol}$=$\frac{3}{965}$mol,根据电子转移守恒,生成高锰酸钾的物质的量为=$\frac{3}{965}$mol÷(7-6)=$\frac{3}{965}$mol,则生成高锰酸钾的质量为$\frac{3}{965}$mol×158g/mol≈0.49g,
故答案为:0.49.
点评 本题考查物质制备工艺流程、原电池与电解原理,属于拼合型题目,涉及陌生方程式书写、对原理的分析评价、条件控制、化学计算等知识点,是对学生综合能力的考查,注意电化学计算中电子转移守恒的运用.


科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 实验现象 | 解释 |
| A | 反萃取法提取碘的CCl4溶液中的碘 | 向富碘的CCl4溶液中加入足量水、振荡、静置、分液 | 碘在水中溶解度比在CCl4中大 |
| B | 在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液 | 产生蓝色沉淀 | 2Fe3++Fe═3Fe2+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
| C | 向0.1mol/L的Fe(NO3)2溶液中滴加盐酸 | 振荡试管颜色加深 | H+抑制Fe2+水解 |
| D | 让蛋白质从水溶液中析出 | 将CuSO4溶液加入蛋白质中发生盐析 | 重金属无机盐溶液可降低蛋白质的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 将少量碳酸钙粉末加入到饱和NH4Cl溶液中 | 产生气体,粉末溶解 | NH4Cl水解使溶液呈酸性 |
| B | 将BaSO4固体粉末加入饱和Na2CO3溶液中,搅拌,过滤,洗涤,在滤渣中加入稀盐酸 | 产生气体,滤渣部分溶解 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 将黑色氧化铜粉末进行高温加热 | 黑色变成红色 | CuO分解生成铜单质 |
| D | 将某溶液滴加过量的稀盐酸 | 有刺激性气味气体产生,溶液中出现沉淀 | 溶液中一定存在S2-和SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
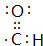 .
.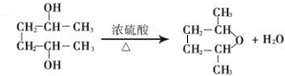 .
.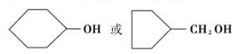 .
.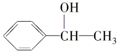 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
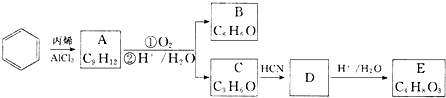
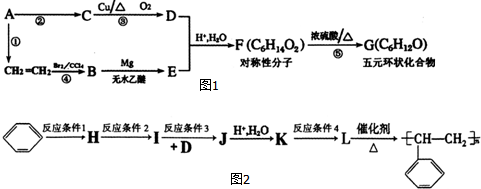
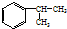 ,A的含有苯环的同分异构体(除A外)有7种.
,A的含有苯环的同分异构体(除A外)有7种.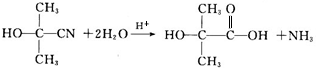 .
.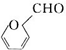 )是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式:
)是一种重要的化工原料,如同甲醛与苯酚反应生成酚醛树脂,它也可与苯酚反应生成糠醛树脂,写出该反应的化学方程式: .
. ,G
,G .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
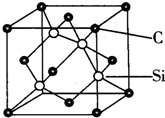 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
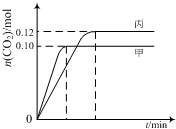 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)| 容器 | 温度/℃ | 起始物质的量/mol | |
| NO (g) | CO (g) | ||
| 甲 | T1 | 0.20 | 0.20 |
| 乙 | T1 | 0.30 | 0.30 |
| 丙 | T2 | 0.20 | 0.20 |
| A. | 该反应的正反应为吸热反应 | |
| B. | 达到平衡时,乙中CO2的体积分数比甲中的小 | |
| C. | T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆) | |
| D. | T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com