


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
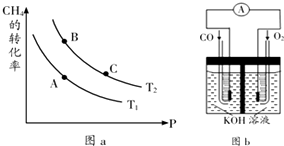
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含C=C的物质一定是烯烃 |
| B、烯烃一定能发生加成反应 |
| C、CH≡CCH2Cl属于不饱和烃 |
| D、最简式为CH2的物质一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铝可通过一步反应而制得金属铝 |
| B、氢氧化铝是难溶于水的两性氢氧化物 |
| C、氢氧化铝能凝聚水中的悬浮物,做净水剂 |
| D、氢氧化铝能受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+、Fe3+ |
| B、Fe2+、Cu2+ |
| C、Fe3+、Cu2+ |
| D、Cu+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag | B、Cu | C、Fe | D、Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在电解池中与外接电源负极相连的电极是阳极 |
| B、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| C、电解氯化铜溶液时,在阴极上有气体生成 |
| D、电解稀硫酸溶液,实质上是电解水,故溶液pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量气泡产生 |
| B、溶液颜色先变为蓝色 |
| C、最后溶液褪色 |
| D、最后溶液变为蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com