
| A.浓H2SO4有氧化性,稀H2SO4无氧化性 |
| B.由于浓H2SO4具有脱水性,所以可用做干燥剂 |
| C.稀H2SO4与铜不反应,浓H2SO4在加热条件下可与铜反应 |
| D.在受热的情况下浓硫酸也不与铁、铝发生反应 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
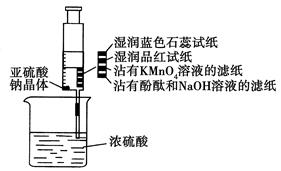
| A.蓝色石蕊试纸先变红后褪色 |
| B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性 |
| C.品红试纸褪色,证明了SO2的漂白性 |
| D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
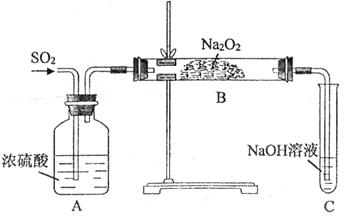
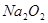 和
和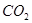 的反应,用类比的方法推理
的反应,用类比的方法推理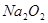 与
与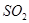 反应的固体产物为__________。另一部分同学依据
反应的固体产物为__________。另一部分同学依据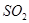 的强还原性和
的强还原性和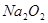 的强氧化性,猜想产物中含有
的强氧化性,猜想产物中含有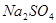 。为检验生成物中是否存在
。为检验生成物中是否存在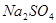 ,他们设计了如下实验方案:
,他们设计了如下实验方案: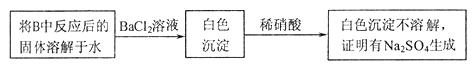
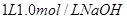 溶液中缓慢通入
溶液中缓慢通入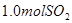 气体,请分析通入
气体,请分析通入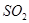 物质的量与溶液中溶质组成的关系,填写下表空格。
物质的量与溶液中溶质组成的关系,填写下表空格。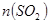 的范围 的范围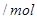 | 溶液中溶质的化学式 |
| (0,0.5) | __________ |
| __________ | 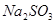 、 、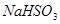 |
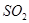 物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)
物质的量的变化曲线。(作图时请在起点、拐点和终点注明坐标)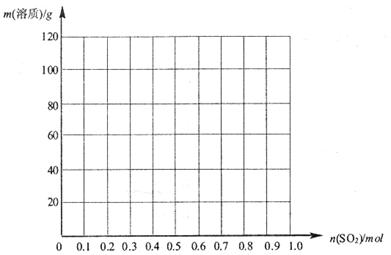
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2S和稀硫酸 | B.Na2SO3和盐酸 | C.Na2S和盐酸 | D.Na2SO3和稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2使酸性KMnO4溶液褪色 | B.SO2使溴水褪色 |
| C.SO2使品红溶液褪色 | D.SO2使含酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 现 象 | 解 释 |
| A | 浓HNO3在光照条件下变黄 | 浓硝酸不稳定,分解产生NO2能溶于浓硝酸 |
| B | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| C | 某溶液中加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向盐酸中加入浓硫酸时产生白雾 | 说明浓硫酸具有脱水性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
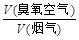 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com