
| A. | ①②⑤ | B. | ①③⑤ | C. | ②④ | D. | ② |
分析 ①MnO4-为紫色;
②pH=11的溶液,显碱性,该组离子之间不反应;
③水电离的H+浓度为10-12mol/L的溶液,为酸或碱溶液;
④使甲基橙变红的溶液,显酸性,离子之间发生氧化还原反应;
⑤加入铝单质产生氢气的溶液,为非氧化性酸或强碱溶液.
解答 解:①MnO4-为紫色,与无色不符,故错误;
②pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故正确;
③水电离的H+浓度为10-12mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-、SO32-,且SO32-、NO3-发生氧化还原反应,碱溶液中不能大量存在NH4+,故错误;
④使甲基橙变红的溶液,显酸性,Fe2+、H+、NO3-(或MnO4-)发生氧化还原反应,不能大量共存,故错误;
⑤加入铝单质产生氢气的溶液,为非氧化性酸或强碱溶液,酸溶液中不能大量存在S2O32-,碱溶液中不能大量存在Mg2+、NH4+,故错误;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2O | B. | CaO(s) | C. | CaCO3 (s) | D. | NaOH (s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
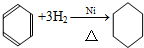 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,HF为液态,是因为氢氟键很稳定 | |
| B. | N最外层有5个电子,所以负化合价只有-3价 | |
| C. | 硅和锗处于金属与非金属的过渡位置,硅和锗都可用作半导体材料 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能、潮汐能、风力发电,可以获取清洁能源 | |
| B. | 利用可降解的“玉米塑料”生产一次性饭盒,可防止白色污染 | |
| C. | 化学药品着火,都要立即用水或泡沫灭火器灭火 | |
| D. | 采用纳米二氧化钛光触媒技术可将汽车尾气中的NO和CO转化为无害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )
我国科学家屠呦呦因发现并成功提取出青蒿素(一种治疗疟疾的药物)而获得2015年诺贝尔生理学或医学奖.青蒿素结构简式如图(结构中有过氧键,与H2O2有相似的化学性质),下列关于青蒿素的说法不正确的是( )| A. | 属于有机物 | |
| B. | 青蒿素具有一定的氧化性 | |
| C. | 青蒿素化学式为C15H20O5 | |
| D. | 青蒿素在一定的条件下能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com