
| A、③⑤ | B、①②④ |
| C、全部正确 | D、②④⑤ |


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、Cl2+H2O═HCl+HClO |
| B、2Na+2H2O═2NaOH+H2↑ |
| C、P2O5+3H2O═2H3PO4 |
| D、3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硒的原子半径比氧原子大 |
| B、H2Se沸点比H2O高 |
| C、硒的非金属性比氧元素弱 |
| D、硒的最高价氧化物对应水化物的化学式为H2SeO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.79×10-20 kJ |
| B、3.59×10-20 kJ |
| C、1.08×104kJ |
| D、2.16×104kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 mol A+2 mol B |
| B、3 mol C+1 mol D+l mol B |
| C、3 mol C+0.8 molD |
| D、1.6 mol A+0.8 mol B+0.6 mol C+0.2 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6molA+2molB |
| B、3molA+1molB+2molC |
| C、2molC+1molB+1molD |
| D、1molC+2molD |
查看答案和解析>>
科目:高中化学 来源: 题型:
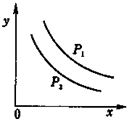 反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是
反应:L(固)+aG(气)?bR(气)达到平衡时,温度和压强对该反应的影响如图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断上述反应是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com