
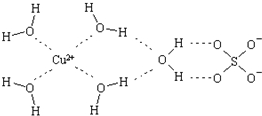
 æĘѧ¼ŅĶعżXÉäĻßĶĘ²āµØ·ÆÖŠ¼Čŗ¬ÓŠÅäĪ»¼ü£¬ÓÖŗ¬ÓŠĒā¼ü£¬Ęä½į¹¹Ź¾ŅāĶ¼æɼņµ„±ķŹ¾ČēĻĀ£¬ĘäÖŠÅäĪ»¼üŗĶĒā¼ü¾ł²ÉÓĆŠéĻß±ķŹ¾£®
æĘѧ¼ŅĶعżXÉäĻßĶĘ²āµØ·ÆÖŠ¼Čŗ¬ÓŠÅäĪ»¼ü£¬ÓÖŗ¬ÓŠĒā¼ü£¬Ęä½į¹¹Ź¾ŅāĶ¼æɼņµ„±ķŹ¾ČēĻĀ£¬ĘäÖŠÅäĪ»¼üŗĶĒā¼ü¾ł²ÉÓĆŠéĻß±ķŹ¾£®·ÖĪö £Ø1£©ĶŹĒ29ŗÅŌŖĖŲ£¬ĘäŌ×ÓŗĖĶāÓŠ29øöµē×Ó£¬øł¾Ż¹¹ŌģŌĄķŹéŠ“Ę仳Ģ¬Ō×ÓŗĖĶāµē×ÓÅŲ¼Ź½£»
£Ø2£©¢ŁÅäĄė×Ó[Cu£ØNH3£©4]2+ÖŠŗ¬ÓŠÅäĪ»¼ü£¬²»Ķ¬·Ē½šŹōŌŖĖŲÖ®¼äŠĪ³É¼«ŠŌ¹²¼Ū¼ü£»
¢ŚŠĪ³É4øöÅäĪ»¼ü£¬¾ßÓŠ¶Ō³ĘµÄæռ乹ŠĶ£¬æÉÄÜĪŖĘ½ĆęÕż·½ŠĪ»ņÕżĖÄĆęĢ壬ČēĪŖÕżĖÄĆęĢ壬[Cu£ØNH3£©4]2+ÖŠµÄĮ½øöNH3±»Į½øöCl-Č”“ś£¬Ö»ÓŠŅ»ÖÖ½į¹¹£»
£Ø3£©ŅņĪŖĖ®·Ö×Ó¼ä“ęŌŚĒā¼ü£¬Ēā¼ü»įŹ¹Ė®·Ö×Ó³ÉĪŖµŽŗĻĖ®·Ö×Ó£¬Ź¹µĆĢå»ż±äŠ”£¬ĖłŅŌÓĆÕōĘūĆÜ¶Č·Ø²āµĆµÄH2OµÄĻą¶Ō·Ö×ÓÖŹĮæ±ČĄķĀŪ¼ĘĖć³öĄ“µÄĻą¶Ō·ÖÖŹĮæ½Ļ“ó£»
£Ø4£©°±Ė®ŗĶĮņĖįĶ·“Ӧɜ³ÉĒāŃõ»ÆĶĄ¶É«³Įµķ£¬µ±°±Ė®¹żĮæŹ±£¬°±Ė®ŗĶĒāŃõ»ÆĶ·“Ӧɜ³ÉæÉČÜŠŌµÄĶ°±ĀēŗĻĪļ£®
½ā“š ½ā£ŗ£Ø1£©ĶŹĒ29ŗÅŌŖĖŲ£¬ĘäŌ×ÓŗĖĶāÓŠ29øöµē×Ó£¬øł¾Ż¹¹ŌģŌĄķÖŖ£¬Ę仳Ģ¬Ō×ÓŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ£ŗ1s22s22p63s23p63d104s1»ņ[Ar]3d104s1£¬
¹Ź“š°øĪŖ£ŗ1s22s22p63s23p63d104s1»ņ[Ar]3d104s1£»
£Ø2£©¢Ł[Cu£ØNH3£©4]2+ÖŠCu2+ÓėNH3Ö®¼äµÄ»Æѧ¼üĪŖÅäĪ»¼ü£¬N-HĪŖ¼«ŠŌ¹²¼Ū¼ü£¬¹Ź“š°øĪŖ£ŗAC£»
¢ŚŠĪ³É4øöÅäĪ»¼ü£¬¾ßÓŠ¶Ō³ĘµÄæռ乹ŠĶ£¬æÉÄÜĪŖĘ½ĆęÕż·½ŠĪ»ņÕżĖÄĆęĢ壬ČēĪŖÕżĖÄĆęĢ壬[Cu£ØNH3£©4]2+ÖŠµÄĮ½øöNH3±»Į½øöCl-Č”“ś£¬Ö»ÓŠŅ»ÖÖ½į¹¹£¬ĖłŅŌÓ¦ĪŖĘ½ĆęÕż·½ŠĪ£¬¹Ź“š°øĪŖ£ŗĘ½ĆęÕż·½ŠĪ£»
£Ø3£©ŅņĪŖĖ®·Ö×Ó¼ä“ęŌŚĒā¼ü£¬Ēā¼ü»įŹ¹Ė®·Ö×Ó³ÉĪŖµŽŗĻĖ®·Ö×Ó£¬Ź¹µĆĢå»ż±äŠ”£¬ĖłŅŌÓĆÕōĘūĆÜ¶Č·Ø²āµĆµÄH2OµÄĻą¶Ō·Ö×ÓÖŹĮæ±ČĄķĀŪ¼ĘĖć³öĄ“µÄĻą¶Ō·ÖÖŹĮæ½Ļ“ó£¬
¹Ź“š°øĪŖ£ŗŌŚ½Ó½üĖ®·ŠµćµÄĖ®ÕōĘųÖŠ“ęŌŚŅ»¶ØŹżĮæµÄĖ®·Ö×ÓŅņĒā¼ü¶ųĻą»„”°µŽŗĻ”±ŠĪ³ÉµÄµŽŗĻ·Ö×ÓµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒĖ®µÄŹż±¶£»
£Ø4£©°±Ė®ŗĶĮņĖįĶ·“Ӧɜ³ÉĒāŃõ»ÆĶĄ¶É«³Įµķ£¬µ±°±Ė®¹żĮæŹ±£¬°±Ė®ŗĶĒāŃõ»ÆĶ·“Ӧɜ³ÉæÉČÜŠŌµÄĶ°±ĀēŗĻĪļ£¬ÄŃČÜĪļČܽāµĆµ½ÉīĄ¶É«µÄĶøĆ÷ČÜŅŗ£¬ÓŠ¹Ų·“Ó¦Ąė×Ó·½³ĢŹ½ĪŖ£ŗCu2++2NH3•H2O=Cu£ØOH£©2”ż+2NH4+£»Cu£ØOH£©2+4NH3=Cu£ØNH3£©42++2OH-£¬
¹Ź“š°øĪŖ£ŗCu2++2NH3•H2O=Cu£ØOH£©2”ż+2NH4+£»Cu£ØOH£©2+4NH3=Cu£ØNH3£©42++2OH-£®
µćĘĄ ±¾Ģāæ¼²éµÄÄŚČŻ½ĻŌÓ£¬Éę¼°µ½³£¼ūŌŖĖŲŗĖĶāµē×ÓÅŲ¼”¢½šŹō¾§Ģå½į¹¹”¢ÅäŗĻĪļµÄ½į¹¹ÓŠ¹ŲÖŖŹ¶£¬ÄŃ¶Č²»“ó£¬×¢ÖŲ¶Ō»ł“”ÖŖŹ¶µÄ漲飮


 ŠĀæĪ±źĶ¬²½ŃµĮ·ĻµĮŠ“š°ø
ŠĀæĪ±źĶ¬²½ŃµĮ·ĻµĮŠ“š°ø Ņ»ĻßĆūŹ¦æŚĖćÓ¦ÓĆĢāĢģĢģĮ·Ņ»±¾Č«ĻµĮŠ“š°ø
Ņ»ĻßĆūŹ¦æŚĖćÓ¦ÓĆĢāĢģĢģĮ·Ņ»±¾Č«ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øß“æ¶ČµÄ¹čµ„ÖŹ¹ć·ŗÓĆÓŚÖĘ×÷¹āµ¼ĻĖĪ¬£¬¹āµ¼ĻĖĪ¬ÓöĒæ¼ī»į”°¶ĻĀ·”± | |
| B£® | µŖµÄ¹Ģ¶ØÖ»ÓŠŌŚøßĪĀ”¢øßŃ¹”¢“߻ƼĮµÄĢõ¼žĻĀ²ÅÄÜŹµĻÖ | |
| C£® | ·žÓĆøõŗ¬Į泬±źµÄŅ©ÓĆ½ŗÄŅ»į¶ŌČĖĢ彔浲»»įŌģ³ÉĪ£ŗ¦ | |
| D£® | øßĢśĖį¼Ų£ØK2FeO4£©ŹĒŅ»ÖÖŠĀŠĶ”¢øߊ§”¢¶ą¹¦ÄÜĖ®“¦Ąķ¼Į£¬¼ČÄÜɱ¾śĻū¶¾ÓÖÄܾ»Ė® |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
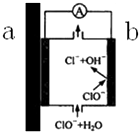 ×ŌĄ“Ė®¹ÜµĄ¾ĄśĮĖ“ÓÖżĢś¹Ü”ś¶ĘŠæ¹Ü”śPVC¹Ü”śPPRČČČŪ¹ÜµČ½×¶Ī£¬ÖżĢś¹Ü”¢¶ĘŠæ¹Ü±»ĘśÓƵÄŌŅņÖ®Ņ»£¬æÉŅŌÓĆŌµē³ŲŌĄķĄ“½āŹĶ£¬Ź¾ŅāĶ¼ČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
×ŌĄ“Ė®¹ÜµĄ¾ĄśĮĖ“ÓÖżĢś¹Ü”ś¶ĘŠæ¹Ü”śPVC¹Ü”śPPRČČČŪ¹ÜµČ½×¶Ī£¬ÖżĢś¹Ü”¢¶ĘŠæ¹Ü±»ĘśÓƵÄŌŅņÖ®Ņ»£¬æÉŅŌÓĆŌµē³ŲŌĄķĄ“½āŹĶ£¬Ź¾ŅāĶ¼ČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | Čē¹ūŹĒ¶ĘŠæ¹Ü£¬Ōņa¶ĖĪŖZn£¬ŹĒøŗ¼«£¬²śÉśZn2+£¬²»µ«»įŌģ³É¹ÜµĄŠāŹ“£¬Zn2+ČÜÓŚ×ŌĄ“Ė®Ņ²¶ŌČĖĢåÓŠŗ¦ | |
| B£® | b¶Ė·¢ÉśµÄµē¼«·“Ó¦ĪŖ£ŗClO-+H2O-2e-ØTCl-+2OH- | |
| C£® | ÓÉÓŚøĆŌµē³ŲŌĄķµÄ“ęŌŚ£¬Ņ»¶Ø³Ģ¶ČÉĻ¼õČõĮĖ×ŌĄ“Ė®ÖŠÓąĀȵÄɱ¾śĻū¶¾¹¦ÄÜ | |
| D£® | “Ó×ŌĄ“Ė®³§µ½ÓĆ»§£¬¾¹żøĆĄą¹ÜµĄµÄ³¤ĘŚ½Ó“„£¬×ŌĄ“Ė®µÄĖį¼īŠŌ·¢ÉśĮĖ±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “ļµ½Ę½ŗāŗó£¬Õāøö·“Ó¦¾ĶĶ£Ö¹£¬Õż·“Ó¦ĖŁĀŹµČÓŚÄę·“Ó¦ĖŁĀŹĒŅĪŖ0 | |
| B£® | ×īÖÕæÉÉś³É0.2 mol NH3 | |
| C£® | Éżó{ĪĀ¶Č£¬·“Ó¦ĖŁĀŹŌö“ó | |
| D£® | µ±VÕż£ØN2£©£ŗV Õż£ØH2£©=1£ŗ3Ź±£¬Ņ»¶Ø“ļ»ÆŃ§Ę½ŗāדĢ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | pH=2µÄHAČÜŅŗÓėpH=12µÄMOHČÜŅŗČĪŅā±Č»ģŗĻ£ŗc£ØH+£©+c£ØM+£©ØTc£ØOH-£©+c£ØA-£© | |
| B£® | ĪļÖŹµÄĮæÅضČĻąµČµÄCH3COONa”¢NaOHŗĶNa2CO3ČżÖÖČÜŅŗ£ŗpH£ØNaOH£©£¾pH£ØCH3COONa£©£¾pH£ØNa2CO3£© | |
| C£® | NaHCO3ČÜŅŗÖŠ£ŗc£ØOH-£©-c£ØH+£©=c£ØH2CO3£©-c£ØCO32-£© | |
| D£® | 10”ꏱpH=12µÄNaOHČÜŅŗÓė40”ꏱpH=12µÄNaOHČÜŅŗÖŠc£ØOH-£©ĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
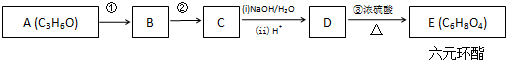
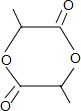 +2H2O£®
+2H2O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| Ź±¼ämin | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n£ØSO2£© | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n£ØO2£© | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n£ØSO3£© | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com