


 .
. .
. .
. 分析 甲能与银氨溶液反应,则甲含有-CHO,甲与氢气发生加成反应生成丙,丙在浓硫酸、加热条件下反应生成丁,丁可以发生加聚反应生成聚苯乙烯,故丁为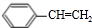 ,则甲为
,则甲为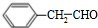 ,丙为
,丙为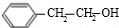 ,甲与HCN发生加成反应、酸化得到乙,则乙为
,甲与HCN发生加成反应、酸化得到乙,则乙为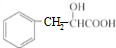 ,由乙与庚的分子式可知,2分子乙脱去形成庚,应是生成环酯,故庚为
,由乙与庚的分子式可知,2分子乙脱去形成庚,应是生成环酯,故庚为 .甲与与银氨溶液发生氧化反应、酸化生成戊为
.甲与与银氨溶液发生氧化反应、酸化生成戊为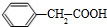 ,戊分子羧基中-OH被Cl原子取代生成己为
,戊分子羧基中-OH被Cl原子取代生成己为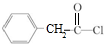 ,辛与有机物M发生聚合反应生成高分子树脂,由高分子树脂的结构可知,应是
,辛与有机物M发生聚合反应生成高分子树脂,由高分子树脂的结构可知,应是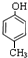 与HCHO发生的加聚反应,而辛与己发生反应生成壬,由信息可知,辛应含有羟基,故辛为
与HCHO发生的加聚反应,而辛与己发生反应生成壬,由信息可知,辛应含有羟基,故辛为 ,M为HCHO,壬为
,M为HCHO,壬为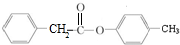 ,据此解答.
,据此解答.
解答 解:甲能与银氨溶液反应,则甲含有-CHO,甲与氢气发生加成反应生成丙,丙在浓硫酸、加热条件下反应生成丁,丁可以发生加聚反应生成聚苯乙烯,故丁为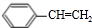 ,则甲为
,则甲为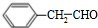 ,丙为
,丙为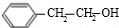 ,甲与HCN发生加成反应、酸化得到乙,则乙为
,甲与HCN发生加成反应、酸化得到乙,则乙为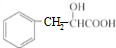 ,由乙与庚的分子式可知,2分子乙脱去形成庚,应是生成环酯,故庚为
,由乙与庚的分子式可知,2分子乙脱去形成庚,应是生成环酯,故庚为 .甲与与银氨溶液发生氧化反应、酸化生成戊为
.甲与与银氨溶液发生氧化反应、酸化生成戊为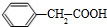 ,戊分子羧基中-OH被Cl原子取代生成己为
,戊分子羧基中-OH被Cl原子取代生成己为 ,辛与有机物M发生聚合反应生成高分子树脂,由高分子树脂的结构可知,应是
,辛与有机物M发生聚合反应生成高分子树脂,由高分子树脂的结构可知,应是 与HCHO发生的加聚反应,而辛与己发生反应生成壬,由信息可知,辛应含有羟基,故辛为
与HCHO发生的加聚反应,而辛与己发生反应生成壬,由信息可知,辛应含有羟基,故辛为 ,M为HCHO,壬为
,M为HCHO,壬为 ,
,
(1)甲为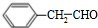 ,含氧官能团是:醛基,故答案为:醛基;
,含氧官能团是:醛基,故答案为:醛基;
(2)乙→庚是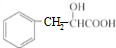 发生酯化反应生成
发生酯化反应生成 ,也属于取代反应,故答案为:酯化反应或取代反应;
,也属于取代反应,故答案为:酯化反应或取代反应;
(3)丙→丁反应的化学方程式为: ,
,
故答案为: ;
;
(4)甲为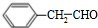 ,含氧官能团是:醛基,检验醛基常用的化学试剂为:银氨溶液(或新制氢氧化铜悬浊液),与银氨溶液反应方程式为
,含氧官能团是:醛基,检验醛基常用的化学试剂为:银氨溶液(或新制氢氧化铜悬浊液),与银氨溶液反应方程式为 ,
,
故答案为:
(5)由上述发信息可知,庚的结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断,根据丁的加聚产物结构综合分析推断甲,再根据反应条件及有机物分子式、结构进行推断,是对有机化学基础的综合考查,难度中等.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
 已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )
已知NaCl的摩尔质量为Mg•mol-1,食盐晶体的密度为ρ•cm-3,若图中N+与邻近的C-的核间距离为acm,那么阿伏加德罗常数的值表示为( )| A. | 2Ma3ρ | B. | $\frac{M}{{a}^{3}ρ}$ | C. | $\frac{2M}{{a}^{3}ρ}$ | D. | $\frac{M}{2{a}^{3}ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胆矾(CuSO4•5H2O) | B. | 磁性氧化铁(Fe3O4) | C. | 苏打(NaHCO3) | D. | 铁锈(Fe2O3•xH2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )
化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示.下列说法不正确的是 (相对原子质量 O-16)( )| A. | A为电源的正极 | |
| B. | 溶液中H+从阳极向阴极迁移 | |
| C. | Ag-Pt电极的电极反应式为2NO3-+12H++10e-═N2↑+6H2O | |
| D. | 电解过程中,每转移2 mol电子,则左侧电极就产生32gO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等.生产乙炔的方法有多种,如电石法、甲烷裂解法等.
乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等.生产乙炔的方法有多种,如电石法、甲烷裂解法等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温Kb[(CH3)2NH]=1.6×10-4.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液电导率越大导电能力越强.常温下用0.100mol•L-1盐酸分别滴定10.00mL浓度均为0.100mol•L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氮相似,常温Kb[(CH3)2NH]=1.6×10-4.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线②代表滴定二甲胺溶液的曲线 | |
| B. | A点溶液中:c(H+)=c(OH-)+c[(CH3)2NH•H2O] | |
| C. | D点溶液中:2c(Na+)=3c(Cl-) | |
| D. | 在相同温度下,A、B、C、D四点的溶液中,水的电离程度最大的是C点 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | NaCl | MgCl2 | AlCl3 | CCl4 |
| 熔点/℃ | 801 | 712 | 190 | -22.6 |
| 沸点/℃ | 1 413 | 1 412 | 182.7 | 76.8 |
| A. | 只有(1)和(2) | B. | 只有(3) | C. | 只有(1)(2)(3) | D. | 全部正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com