
| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
分析 根据氮气浓度的变化量计算参加反应的氢气的物质的量浓度,再根据v=$\frac{△c}{△t}$计算v(H2).
解答 解:2s时测得N2的浓度为0.3mol/L,则氮气物质的量浓度变化量=$\frac{1mol}{2L}$-0.3mol/L=0.2mol/L,N2+3H2=2NH3,
化学方程式计算得到消耗的氢气的物质的量浓度是0.6mol/L,所以当用氢气浓度的减少来表示该反应的反应速率时,该反应的反应速率=$\frac{0.6mol/L}{2s}$=0.3mol/(L•s).
故选D.
点评 本题考查学生化学反应速率的计算方法知识,注意公式的记忆和应用是关键,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
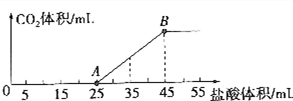
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
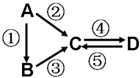 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中共消耗1.8 mol H2SO4 | B. | 气体甲中SO2与H2的体积比为4:1 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 反应中共转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | 全部 | C. | ②④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在乙醇的液面上游动 | B. | 钠块熔化成小球 | ||
| C. | 钠块沉在乙醇液面的下面 | D. | 钠块表面没有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
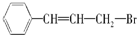 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 易溶于水,也易溶于有机溶剂 | |
| B. | 能使溴水褪色,但不能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol 该有机物可以与4 mol Br2加成 | |
| D. | 在NaOH水溶液中可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
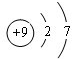 .
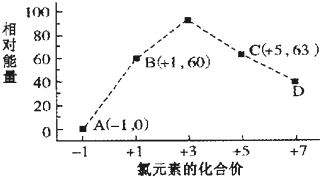
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com