
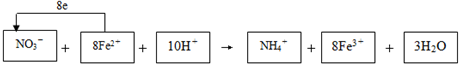
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、Na+、NH4+、OH-、HCO3- |
| B、Mg2+、Ag+、NO3-、SiO32- |
| C、K+、Cu2+、Cl-、SO42- |
| D、H+、Fe3+、I-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c (Na+) |
| B、c(Na+)+c(H+)=c(OH-)+c(CH3COOH)+c(CH3COO-) |
| C、c(CH3COOH)>c(CH3COO-) |
| D、c(CH3COOH)+c(CH3COO-)=0.02mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.2mol |
| B、0.6mol |
| C、0.3mol |
| D、0.15mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
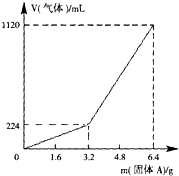 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3溶于氢碘酸:Fe2O3+6HI=2Fe3++6I-+3H2O |
| B、Na2S溶液显碱性:S2-+2H2O=H2S+2OH- |
| C、CH3COOH与NaOH溶液反应:H++2OH-=H2O |
| D、AgNO3溶液中加入过量氨水:Ag++2NH3?H2O=Ag(NH3)2++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com