
 取m1g某常见粉末(由M、Z两种元素组成)进行如下实验.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.
取m1g某常见粉末(由M、Z两种元素组成)进行如下实验.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.
| ||
| m1 |
| m2 |
| 2×(56×x+16×y) |
| (2x×56) |
| ||
| ||
| ||
| ||
| ||
| ||


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
 取m1g某常见黑色粉末(由M、Z两种元素组成)进行如下实验以确定组成.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成.同时,b瓶的溶液中出现白色浑浊.经一系列测定,确定反应完全 后,停止加热,继续通氮气,直到反应管冷却.此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2.根据以上叙述回答问题:
取m1g某常见黑色粉末(由M、Z两种元素组成)进行如下实验以确定组成.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成.同时,b瓶的溶液中出现白色浑浊.经一系列测定,确定反应完全 后,停止加热,继续通氮气,直到反应管冷却.此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2.根据以上叙述回答问题:查看答案和解析>>
科目:高中化学 来源:2011届上海市奉贤区高三4月调研测试(二模)化学试卷 题型:实验题
取m1g某常见粉末(由M、Z两种元素组成)进行如下实验。将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水。按图连接仪器并检查好气密性。
实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。经一系列测定,确定反应完全后,停止加热,继续通氮气,直到反应管冷却。此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2。根据以上叙述回答问题:
(1)该粉末的化学式是_________ ____;操作G是______________________。
____;操作G是______________________。
(2)停止加热前是否需要先关闭止水夹K?_________;原因:_____________。
(3)反应管a中产生金属单质的化学方程式为:__________________________。 (4)本实验的尾气是否需处理?_______;如需处理,请回答如何处理;如不需处理,
(4)本实验的尾气是否需处理?_______;如需处理,请回答如何处理;如不需处理,
请说明理由。_______________________________________________。
(5)在题目“一系列测定”中,当连续_____________时,则可确定反应管中反应已完全。
(6)某同学做该实验时,b瓶最终得到了澄清溶液,他向该溶液中加入了某物质,溶液又出现了浑浊。请书写出现浑浊的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
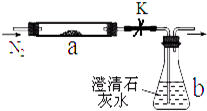 取m1g某常见黑色粉末(由M、Z两种元素组成)进行如下实验以确定组成.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成.同时,b瓶的溶液中出现白色浑浊.经一系列测定,确定反应完全 后,停止加热,继续通氮气,直到反应管冷却.此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2.根据以上叙述回答问题:
取m1g某常见黑色粉末(由M、Z两种元素组成)进行如下实验以确定组成.将该粉末和足量碳粉充分混合,平铺在反应管a中,b瓶中盛足量澄清石灰水.按图连接仪器并检查好气密性.实验开始时,先进行操作G,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成.同时,b瓶的溶液中出现白色浑浊.经一系列测定,确定反应完全 后,停止加热,继续通氮气,直到反应管冷却.此时,管中的熔融物凝固成银白色金属M,再进行分离、提纯、称量,得到m2g纯金属M,且m1=1.38m2.根据以上叙述回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com