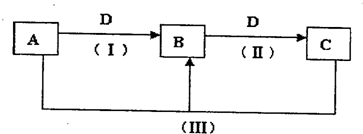
(2011?焦作一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.
请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,A和D反应生成B的化学方程式为
4NH3+3O2=2N2+6H2O
4NH3+3O2=2N2+6H2O
.B的结构式为
N≡N
N≡N
.
(2)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,继续灼烧后得到的固体物质成分是
Fe2O3;
Fe2O3;
.
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①C溶液呈碱性的原因是
HCO3-+H2O?H2CO3+OH-
HCO3-+H2O?H2CO3+OH-
.(用离子方程式表示)
②将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小的顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.

 (2011?焦作一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.
(2011?焦作一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.

 名校课堂系列答案
名校课堂系列答案 (2011?焦作一模)化学-选修物质结构与性质:
(2011?焦作一模)化学-选修物质结构与性质: