
| A. | NA个N2分子和NA个CO2原子个数比为1:1 | |
| B. | 1 mol H2O的质量与NA个H2O质量的总和几乎相等 | |
| C. | 1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
分析 A、氮气为双原子分子,而二氧化碳为三原子分子;
B、1mol水中含NA个水分子;
C、氢气为双原子分子;
D、粒子种类指代不明.
解答 解:A、氮气为双原子分子,而二氧化碳为三原子分子,故NA个氮气分子中含2NA个原子,而NA个二氧化碳分子中含3NA个原子,个数之比为2:3,故A错误;
B、1mol水中含NA个水分子,故NA个水分子的质量和即为1mol水的质量,故B正确;
C、氢气为双原子分子,故1mol氢气中含2NA个原子,故C错误;
D、粒子种类指代不明,没指明粒子到底是原子还是分子,或是电子、中子和质子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol H2O中含有的原子总数为1.5 NA | |
| B. | 0.2mol O2 所占有的体积为4.48L | |
| C. | 22g 二氧化碳气体中所含有的分子数目为0.5 NA | |
| D. | 100mL2mol/L的Na2CO3溶液中含有的Na+数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
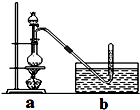 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 | |
| B. | 第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 | |
| C. | 第三周期气态氢化物的沸点均为同主族中沸点最低的,是因为其分子内含有氢键 | |
| D. | 第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)═C(金刚石,s)△H﹦+1.9kJ•mo1-1,说明金刚石具有的能量比石墨低 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(1)△H﹦-57.4KJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ | |
| C. | 已知甲烷的燃烧热为890.3kJ•mo1-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H﹦-890.3kJ•mo1-1 | |
| D. | 将0.5mo1N2和1.5mo1H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H﹦-38.6kJ•mo1-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 只用少量水就可鉴别Na2CO3和NaHCO3固体 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com