
| A. | 元素B和E的最高价氧化物对应的水化物均为强酸 | |
| B. | A、B的气态氢化物的稳定性:A>B | |
| C. | 元素C、D、E的最高价氧化物对应的水化物之间均可相互反应 | |
| D. | 工业上常用电解元素C、D的氯化物来制取它们的单质 |
分析 短周期主族元素A、B、C、D、E的原子序数依次递增,E原子最外层电子数是B原子内层电子数的3倍,则B只能有2个电子层,处于第二周期,故E原子最外层电子数为6,E原子最外层电子数是C原子最外层电子数的3倍,则C原子最外层电子数为2,B、C、E原子的最外层电子数之和为13,则B原子最外层电子数=13-6-2=5,则B为N元素;A、B两元素相邻,A原子序数小于B,则A为C元素,结合原子序数可知,C、D、E只能处于第三周期,故E为S元素,故C为Mg;B、D原子最外层电子数之和等于C、E原子最外层电子数之和,则D原子最外层电子数=2+6-5=3,则D为Al,据此解答.
解答 解:短周期主族元素A、B、C、D、E的原子序数依次递增,E原子最外层电子数是B原子内层电子数的3倍,则B只能有2个电子层,处于第二周期,故E原子最外层电子数为6,E原子最外层电子数是C原子最外层电子数的3倍,则C原子最外层电子数为2,B、C、E原子的最外层电子数之和为13,则B原子最外层电子数=13-6-2=5,则B为N元素;A、B两元素相邻,A原子序数小于B,则A为C元素,结合原子序数可知,C、D、E只能处于第三周期,故E为S元素,故C为Mg;B、D原子最外层电子数之和等于C、E原子最外层电子数之和,则D原子最外层电子数=2+6-5=3,则D为Al,
A.元素B和E的最高价氧化物对应的水化物分别为硝酸、硫酸,均属于强酸,故A正确;
B.非金属性A<B,故B元素氢化物稳定性强,故B错误;
C.元素C、D、E的最高价氧化物对应的水化物分别为氢氧化镁、氢氧化铝、硫酸,氢氧化镁与氢氧化铝之间不能反应,故C错误;
D.工业上电解氯化镁生成Mg,由于氯化铝是共价化合物,不导电,工业上电解熔融氧化铝生成Al,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,判断X为第二周期元素为突破口,侧重考查学生分析推理能力、元素化合物知识.


科目:高中化学 来源: 题型:解答题

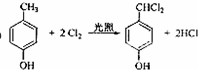 ,该反应类型为取代反应.
,该反应类型为取代反应.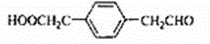 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠受热分解 | B. | 氨气与氯化氢气体反应 | ||
| C. | C(s,石墨)+H2O(g)═CO(g)+H2(g) | D. | 液态水气化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液有白色沉淀生成,该溶液中一定含SO42- | |
| B. | 向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解 | |
| C. | 除去苯中含有的苯酚,可先加NaOH溶液,充分反应后静置分液 | |
| D. | 淀粉和稀硫酸混合加热一段时间后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
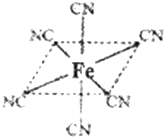 第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
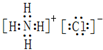 、用电子式表示⑥号物质的形成过程:
、用电子式表示⑥号物质的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③ | C. | ①③⑤ | D. | ②④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com