
【题目】某实验小组在T1温度下,容积为1 L的恒容密闭容器中,同时通入0.1 mol CO(g)和0.1 mol H2O(g),发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
CO2(g)+H2(g) △H=a kJ· mol-1。测得CO2的物质的量浓度随时间的变化关系如图所示。
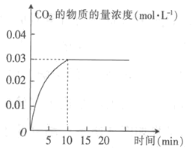
(1)0~10min内,CO的平均反应速率为_______________。
(2)T1温度下,该反应的平衡常数K为________(用分数表示)。
(3)①已知:
I.H2的燃烧热△H=-285.8 kJ· mol-1;
II.CO的燃烧热△H=-283 kJ· mol-1;
III.H2O(g)=H2O(l) △H=-44 kJ· mol-1。
则a=_______。
②反应达到平衡后,下列措施能使平衡向正反应方向移动的是__________(填字母)。
A 升高温度 B 增大压强 C 通入H2O(g) D 移走CO2(g)
(4)T1温度下,某时刻另一实验小组测得反应容器中有关数据为c(CO)=0.6 mol·L-1、c(H2O)=1.6 mol·L-1,c(H2)=0.4 mol·L-1,c(CO2)=0.4 mol·L-1,则该反应在下-时刻将____(填“向正反应方向进行”“向逆反应方向进行”或“达到平衡”),判断依据是_______。
【答案】0.003mol·L-1·min-1 ![]() -41.2 CD 向正反应方向进行
-41.2 CD 向正反应方向进行 ![]() <K,所以反应向正反应方向进行
<K,所以反应向正反应方向进行
【解析】
(1)利用![]() ,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比;
,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比;
(2)利用三等式,求解平衡常数;
(3)①利用盖斯定律,求解反应热;
②根据勒夏特列原理判断平衡移动;
(4)利用浓度商Qc和K的关系,判断平衡移动方向。
(1)根据图示,0~10min内,CO2的浓度增加了0.03mol·L-1,则![]() ,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比,即
,同一化学反应中,用不同的物质表示反应速率其数值之比等于计量数之比,即![]() ,则
,则![]() ;
;
(2) 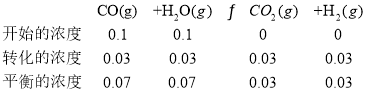
则![]() ;
;
(3)①H2的燃烧热的热化学方程式H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ·mol-1 ①;
CO的燃烧热的热化学方程式CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1 ②;
H2O(g)=H2O(l) △H=-44 kJ· mol-1 ③,则②-①+③得到CO(g)+H2O(g)![]() CO2(g)+H2(g),△H=-283-(-285.8)+(-44)kJ·mol-1=-41.2 kJ·mol-1,则a=-41.2;
CO2(g)+H2(g),△H=-283-(-285.8)+(-44)kJ·mol-1=-41.2 kJ·mol-1,则a=-41.2;
②A、升高温度,向吸热反应方向移动,即逆向移动,A不符合题意;
B、由于反应前后气体体积不变,增大压强,平衡不移动,B不符合题意;
C、通入H2O,增大反应物浓度,正向移动,C符合题意;
D、移走CO2,减小生成物浓度,正向移动,D符合题意;
答案为CD;
(4)利用浓度商Q与K的关系判断平衡移动方向,![]() <K,则平衡正向移动,答案为向正反应方向进行,
<K,则平衡正向移动,答案为向正反应方向进行,![]() <K,所以反应向正反应方向进行。
<K,所以反应向正反应方向进行。


科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W、M五种短周期元素,它们满足如下关系:①原子序数依次增大;②ZX4++WX-=ZX3+X2W,且反应物和产物中各微粒的电子总数与M+相等,均为10个;③Z2与YW分子中质子数相等。回答下列问题:
(1)YW2的电子式:______________;实验室中MWX溶液的保存方法是:________
(2)由X、Y、Z、W四种元素共同组成的离子化合物A,其原子个数比为5:1:1:3,则A的水溶液与足量的MWX溶液反应的离子方程式为:_________________________
(3)M2W2投入足量Na2S溶液中,生成浅黄色沉淀的离子方程式为:_______________
(4)与M同族的元素B和B2W共n 克投入到足量的X2W中完全反应,生成物蒸干后得1.25n 克化合物BWX,B是________(填元素名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下: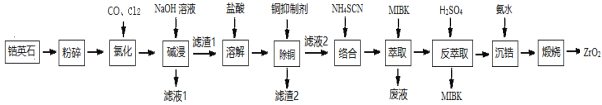
已知:①锆英石中锆元素的化合价为+4 ,“氯化”过程中除C、O元素外,其他元素均转化为最高价氯化物 ②SiCl4极易水解;ZrCl4易溶于水 ③Fe(SCN)3难溶于有机溶剂MIBK; Zr(SCN)4在水中溶解度不大,易溶于有机溶剂MIBK。
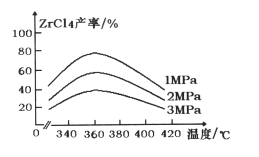
(1) “氯化”过程中,锆英石发生的主要反应的化学方程式为:______________________________,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_____________;
(2)“滤液1”中含有的阴离子除OH- 、Cl-,还有___________________;
(3)常用的铜抑制剂有Na2S、H2S、NaCN等,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________。
(4)实验室进行萃取和反萃取的玻璃仪器是_______。流程中萃取与反萃取的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置。在实验开始时温度计水银球的位置应在___________,目的是_____________________________;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在___________________。

(3)烧杯B内盛装的液体可以是____________(写出一种即可)。
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是____________。(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.有氧气参与的反应都是放热反应
B.热化学方程式既表示能量的变化,又表示物质的变化
C.若2CO2(g)![]() 2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
D.放热反应理论上都可以设计为原电池,将化学能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其他产物及反应条件已略去,反应可以在水溶液中进行):![]() 。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
。三种物质的焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)写出下列物质的化学式A______,B________,C________,W________。
(2)写出A溶液与C溶液反应的离子方程式为_______________________________。
(3)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.25 mol·L-1盐酸,如图所示Ⅰ和Ⅱ分别为加入V(盐酸)与产生V(W)的关系。通过计算确定A溶液的物质的量浓度为 _______________。

(4)M、N两溶液中相同溶质的物质的量之比为多少_______?(写出必要的文字说明和计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2g/mL,质量分数为36.5%的浓盐酸配制250mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为__mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、__、__。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是__。
A.量取浓盐酸时俯视刻度线
B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线
D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出Fe的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。其原因是__________,将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
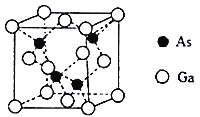
(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题。

(1)第三周期元素中非金属性最强的元素的原子结构示意图是___。
(2)②③⑦最高价氧化物对应水化物的酸性由强到弱的顺序是___(填化学式)。
(3)下列可以判断⑤和⑥金属性强弱的是___(填序号)。
a.单质的熔点:⑤<⑥
b.化合价:⑤<⑥
c.单质与水反应的剧烈程度:⑤>⑥
d.最高价氧化物对应水化物的碱性:⑤>⑥
(4)为验证第ⅦA族部分元素非金属性的递变规律,设计如图装置进行实验,请回答:
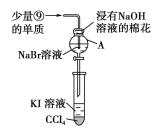
①仪器A的名称是___,A中发生反应的离子方程式是___。
②棉花中浸有NaOH溶液的作用是___(用离子方程式表示)。
③验证溴与碘的非金属性强弱:通入少量⑨的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到___。该实验必须控制⑨单质的加入量,否则得不出溴的非金属性比碘强的结论。理由是___。
④第ⅦA族元素非金属性随元素核电荷数的增加而逐渐减弱的原因:同主族元素从上到下原子半径逐渐_____(填“增大”或“减小”),得电子能力逐渐减弱。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com