
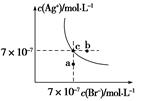
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq)  AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) |
| D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
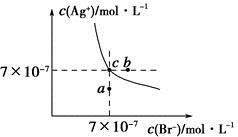
| A.在t ℃时,AgBr的Ksp为4.9×10-13 |
| B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| C.图中a点对应的是AgBr的不饱和溶液 |
D.在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816 AgBr(s)+Cl-(aq)平衡常数K≈816 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向饱和AgCl水溶液中加入盐酸,Ksp变大 |
| B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
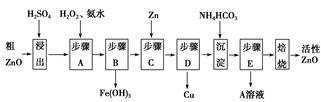
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7 Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com