
【题目】物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A是一种能使红色石蕊试液变蓝的气体,甲为淡黄色固体化合物,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成。请回答下列问题:
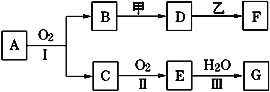
(1)写出甲的电子式是___________;
(2)写出反应Ⅰ的化学方程式__________;
(3)A溶于水得到溶液X,在25℃下,将a mol·L-1的X与b mol·L-1的G溶液等体积混合,溶液显中性,则所得溶液中离子浓度由大到小的顺序为______________;用含a和b的代数式表示出该混合溶液中X的电离平衡常数_______________________。
(4)工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过如图装置处理污水。
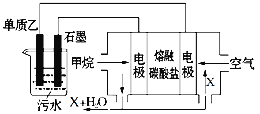
① 电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是:Ⅰ.___; Ⅱ.______。
② 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分X物质参加循环,X物质的化学式是_______________________。
【答案】![]() 4NH3+5O2
4NH3+5O2 ![]() 4NO+6H2O c(NO3—)=c(NH4+)>c(OH—)= c(H+)
4NO+6H2O c(NO3—)=c(NH4+)>c(OH—)= c(H+) ![]() Al—3e—= Al3+ 4OH- —4e-= 2H2O + O2↑ CO2
Al—3e—= Al3+ 4OH- —4e-= 2H2O + O2↑ CO2
【解析】
A是一种能使红色石蕊试液变蓝的气体,则A为NH3;甲为淡黄色固体化合物,应为Na2O2,用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成,说明A应为NH3,G为HNO3,则C为NO,B为H2O,E为NO2,乙在G的浓溶液中发生钝化,应为Al,生成F为NaAlO2,根据物质的性质结合题目的要求可解答该题。
(1)由以上分析可知甲为淡黄色固体化合物,应为Na2O2,为离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)用两根玻璃棒分别蘸取化合物A、G的浓溶液并使它们接近,有大量白烟生成,说明A应为NH3,G为HNO3,则B为H2O,E为NO2 ,C为NO,反应Ⅰ为氨气的催化氧化反应,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)A为NH3,G为HNO3,溶液混合后存在电荷守恒:c(NO3-)+c(OH-)=c(NH4+)+c(H+),因为溶液显中性,则c(OH-)=c(H+)、c(NO3-)=c(NH4+),中性溶液中c(OH-)、c(H+)较小,则c(NO3-)=c(NH4+)>c(OH-)=c(H+);反应后剩余n(NH3H2O)=(a-b)mol,n(NH4+)=n(NO3-)=bmol,c(OH-)=10-7mol/L,则k=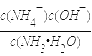 =
=![]() =
= ![]() (假定混合后溶液的体积为V),故答案为:c(NO3-)=c(NH4+)>c(OH-)=c(H+);
(假定混合后溶液的体积为V),故答案为:c(NO3-)=c(NH4+)>c(OH-)=c(H+);![]() ;
;
(4)①电解池阳极为Al,发生了两个电极反应,其中一个反应生成一种无色气体,应生成O2,电极方程式分别为Al-3e-=Al3+、4OH-
故答案为:Al-3e-=Al3+;4OH--4e-=2H2O+O2↑;
②负极电极方程式为CH4-8e-+4CO32-=5CO2+2H2O,正极为2O2+4CO2+8e-=4CO32-,可循环利用的为CO2,故答案为:CO2。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。
C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
E.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤B中不断搅拌的目的是_______。
②步骤C中发生反应的离子方程式为______。
③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2)高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3)高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来解释下列事实的离子方程式正确的是
A.钢铁发生吸氧腐蚀的正极反应:O2+4e—+2H2O=4OH—
B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe(OH)3+3H2O
C.用铜为电极电解饱和食盐水:2Cl—+2H2O![]() Cl2↑+H2↑+2OH—
Cl2↑+H2↑+2OH—
D.碳酸氢钠溶液中加入过量石灰水:HCO3—+OH—=CO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置产生的电能对乙装罝进行铁上镀铜的实验,下列说法中不正确的是
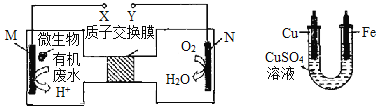
甲 乙
A.H+透过质子交换膜由左向右移动
B.M电极反应式:H2NCONH2+H2O—6e—=CO2↑+N2↑+6H+
C.铁电极应与X相连接
D.当N电极消耗0.5mol气体时,则铁电极增重32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的近似值为6.02×1023.按要求完成下列填空:
(1)1molCl2中约含有______个氯气分子,约含有______个氯原子,含有6.02×1023个氢原子的H2SO4的物质的量是______;
(2)标准状况下11.2LN2O4和______molNO所含有的原子数相等。
(3)某硫酸钠溶液中含有3.01×1023个Na+,则该溶液中SO42-的物质的量是______。
(4)2L1mol/LMgCl2中镁离子的物质的量为______,Cl-的物质的量浓度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,2SO2(g)+O2(g)![]() 2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
2SO3(g) △H= -197 kJ/mol。开始时在10 L的密闭容器中加入4.0 molSO2(g)和10.0 molO2(g),当反应达到平衡时共放出197kJ的热量,该温度下的平衡常数K=_________,升高温度K将_____________(增大、减小或不变)。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是__________________(填字母)。
A.恒温恒容,充入2mol SO3 B.恒温恒容,充入2mol N2
C.恒温恒压,充入1 mol SO3 D.升高温度
(3)在一密闭容器中进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。
2SO3(g),化学兴趣小组的同学探究了其他条件不变时,改变某一条件时对上述反应的影响,并根据实验数据作出了下列关系图。下列判断中正确的是 ____________(填字母)。
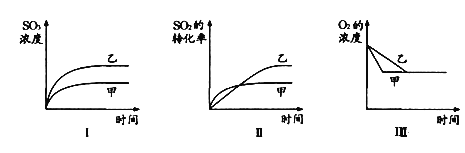
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且乙的温度较低
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
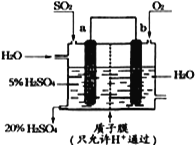
(4)某实验小组设想如右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:___________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:① 2SO2(g)+O2(g)![]() 2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
2SO3(g)△H1= —197 kJ/mol;② H2O(g)=H2O(l)△H2= —44 kJ/mol;③ 2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3= —545 kJ/mol。写出SO3(g)与H2O(l)反应的热化学方程式是_____________________________。
(6)由硫酸可制得硫酸盐,在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,SO42-和CO32-的浓度之比___________________________。 (已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)= 5.2×10-9。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像正确反映对应变化关系的是
A. 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸反应
B. 向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
向一定量的氢氧化钠溶液中滴加pH=3的稀盐酸
C. 加热一定质量的高锰酸钾
加热一定质量的高锰酸钾
D. 氢气还原一定质量的氧化铜
氢气还原一定质量的氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图1所示的质谱图;
③用核磁共振仪处理该化合物,得到如图2所示图谱,图中三个峰的面积之比是1∶2∶3。

试回答下列问题:
(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)能否根据A的实验式确定其分子式________(填“能”或“不能”),若能,则A的分子式是________(若不能,则此空不填)。
(4)写出有机物A的结构简式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com