
下列热化学方程式或说法正确的是 ( )
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ?mol-1 2NH3(g)△H=-38.6kJ?mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
科目:高中化学 来源: 题型:单选题
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列依据热化学方程式得出的结论正确的是( )
| A.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ·mol-1 则含40.0g NaOH的稀溶液与稀醋酸完全中和,放出57.3kJ的热量 |
| C.已知C(石墨,s)=C(金刚石,s);△H>0,则石墨比金刚石稳定 |
| D.己知2C(s)+2O2(g)=2CO2(g));△H=a、2C(s)+O2(g)=2CO(g);△H=b,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列与化学反应能量变化相关的叙述正确的是
| A.反应物的总能量一定高于生成物的总能量 |
| B.铝与氧化铁反应既是氧化还原反应,又是吸热反应 |
| C.化学反应中发生能量变化的根本原因是化学键的断裂与形成 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
①C(s)+O2(g)=CO2(g) ΔH1 C(s)+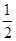 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
②S(s)+O2(g)=SO2(g) ΔH3 S(g)+O2(g)=SO2(g) ΔH4
③H2(g)+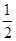 O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
O2(g)=H2O(l) ΔH5 2H2(g)+O2(g)=2H2O(l) ΔH6
④CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
| A.① | B.④ | C.②③④ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
| C.已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ |
| D.已知2C(s)+2O2(g)=2CO2(g)△H1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 | B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 | D.0.5a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com