
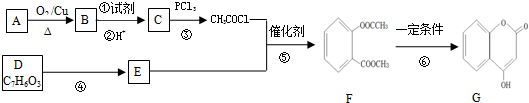
 、
、 .
. (写出一种即可).
(写出一种即可).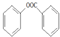 )是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线
)是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线 .
. 分析 由CH3COCl结合题中信息的条件可知,C为CH3COOH,结合A→B的条件可推知B为CH3CHO,A为CH3CH2OH,根据F的结构简式可知,结合CH3COCl可知E为 ,CH3COCl与E发生取代反应生成F,结合D的分子式可知,D为
,CH3COCl与E发生取代反应生成F,结合D的分子式可知,D为 ,以苯酚、甲苯为原料制取苯甲酸苯酚酯,可以先将甲苯氧化成苯甲酸,再与苯酚反应可得苯甲酸苯酚酯,据此答题.
,以苯酚、甲苯为原料制取苯甲酸苯酚酯,可以先将甲苯氧化成苯甲酸,再与苯酚反应可得苯甲酸苯酚酯,据此答题.
解答 解:由CH3COCl结合题中信息的条件可知,C为CH3COOH,结合A→B的条件可推知B为CH3CHO,A为CH3CH2OH,根据F的结构简式可知,结合CH3COCl可知E为 ,CH3COCl与E发生取代反应生成F,结合D的分子式可知,D为
,CH3COCl与E发生取代反应生成F,结合D的分子式可知,D为 ,
,
(1)A为CH3CH2OH,A的名称为乙醇,B为CH3CHO,B中含有的官能团为醛基,
故答案为:乙醇;醛基;
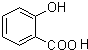
(2)D为 ,E为
,E为 ,
,
故答案为: ;
; ;
;
(3)D发生酯化反应生成E,CH3COCl与E发生取代反应生成F,
故答案为:酯化反应;取代反应;
(4)根据G的结构简式可知,1molG最多能和4molH2反应,
故答案为:4;
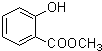
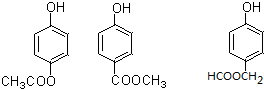
(5)E为 ,E的同分异构体中既能发生水解反应,说明有酯基,又能与FeCl3溶液发生显色反应,说明有酚羟基的结构还有苯环上连有-OH、HCOOCH2-,或-OH、CH3COO-,它们各有邻间对三种,或苯环上连有-OH、-COOCH3,有间位和对位两种,所以共有8种,其中苯环上有两种不同化学环境的氢原子的同分异构体的结构简式是
,E的同分异构体中既能发生水解反应,说明有酯基,又能与FeCl3溶液发生显色反应,说明有酚羟基的结构还有苯环上连有-OH、HCOOCH2-,或-OH、CH3COO-,它们各有邻间对三种,或苯环上连有-OH、-COOCH3,有间位和对位两种,所以共有8种,其中苯环上有两种不同化学环境的氢原子的同分异构体的结构简式是 ,
,
故答案为:8; ;
;
(6)以苯酚、甲苯为原料制取苯甲酸苯酚酯,可以先将甲苯氧化成苯甲酸,再与苯酚反应可得苯甲酸苯酚酯,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高考常见的题型,注意把握合成流程中的反应条件、已知信息等推断各物质,熟悉有机物的结构与性质即可解答,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用 | |
| B. | 氢硫酸是弱酸,不能与强酸盐反应生成强酸 | |
| C. | 稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应 | |
| D. | 硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有还原性 |
| B | 将FeSO4样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | FeSO4样品已氧化变质 |
| C | 将新制氯水和KBr溶液在试管中混合后,加入苯酚,振荡静置 | 溶液分层,下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 分别向0.1mol•L-1酸酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 酸酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物F (C9H10O2) 是一种有茉莉花香味的酯.用下图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链.
有机物F (C9H10O2) 是一种有茉莉花香味的酯.用下图所示的方法可以合成F.其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志.E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | KNO3 | C. | Na2SO4 | D. | FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )
已知:2HI+Cl2═2HCl+I2,I2为固体.常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,两烧瓶内的气体充分混合后,容器内的压强由大到小的顺序正确的是( )| 编号 | ① | ② | ③ | ④ |
| 气体X | HI | NH3 | H2 | SO2 |
| 气体Y | Cl2 | HCl | Cl2 | H2S |
| A. | ②>③>①>④ | B. | ③>①=④>② | C. | ③>①>④>② | D. | ④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
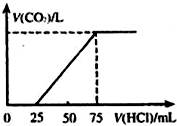 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com