
【题目】某实验小组将SO2通入Na2S和Na2SO3的混合溶液中制备硫代硫酸钠(Na2S2O3)。其装置如下图所示(省略夹持装置),下列说法错误的是
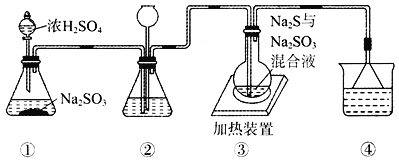
A. 装置②的作用之一是观察SO2的生成速率,其中的液体可以是饱和NaHSO3溶液
B. 为提高产品纯度,使烧瓶中Na2S和Na2SO3恰好完全反应,则![]()
C. 装置④的作用是吸收尾气,同时防止倒吸
D. 装置①也可用于高锰酸钾与浓盐酸反应制备氯气
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
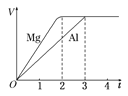
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金、银、铜、铁、铝和钛均是人类大量生产和使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属中属于主族元素的有________。
(2)钛被称为继铁、铝之后的第三金属。基态钛原子外围电子的电子排布图为_____________。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中位于第_____周期第____族。
(4)已知Ag与Cu位于同一族,则Ag在元素周期表中位于________区(填“s”、“p”、“d”、“f”或“ds”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:
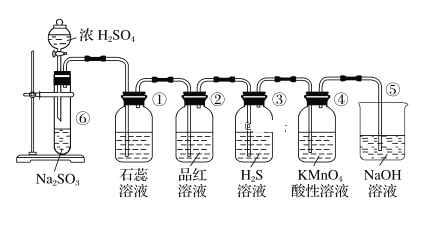
(1)在⑥中发生反应的化学方程式为_____________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2具有____________性。。
(4)③中的实验现象是_______________________,证明SO2有____________性。
(5)④中的实验现象是______________________,证明SO2有_____________性。
(6)⑤装置的作用是___________________________,该反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
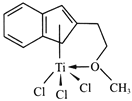
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A.不溶于水,且比水更容易使碘溶解
B.不溶于水,且必须易与碘发生化学反应
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在某温度时发生如下3个反应:
(1)C+CO2=2CO
(2)C+H2O=CO+H2
(3)CO+H2O=CO2+H2
由此判断,在该温度下C、CO、H2的还原性强弱顺序是
A. CO>C>H2B. C>CO>H2
C. C>H2>COD. CO>H2>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com